一. 实验原理及背景
原位杂交可分为菌落原位杂交和组织原位杂交。
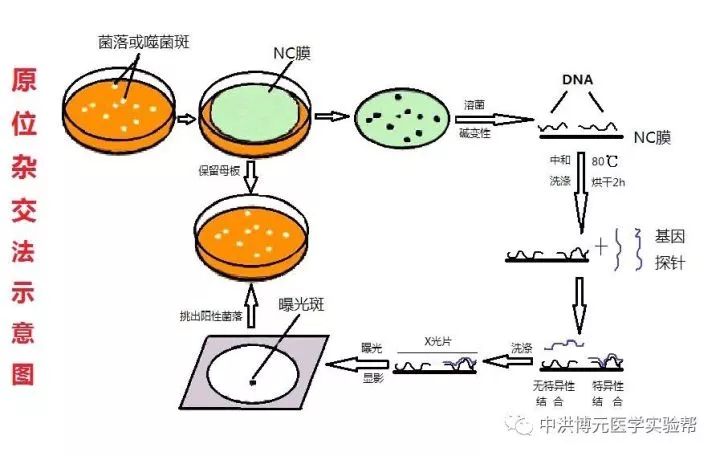
菌落原位杂交是将细菌从培养平板转移到硝酸纤维素滤膜上,然后将滤膜上的菌落裂解以释放DNA。将DNA烘干固定于膜上,然后将滤膜上的菌落裂菌以释放出DNA。将DNA烘干固定于膜上与32P标记的探针杂交,放射自显影检测菌落杂交信号,并与平板上的菌落对位。
组织原位杂交简称原位杂交,指组织或细胞的原位杂交,它与菌落的原位杂交不同。菌落原位杂交需要裂解细菌释放DNA,然后进行杂交。而原位杂交是经适当处理后,使细胞通透性增加,让探针进入细胞内与DNA或RNA杂交。
(图片来源网络)
二. 具体步骤
1、将加入探针的杂交液先于50℃预热,均匀涂于切片表面,加上硅化盖玻片,放于湿盒中,50℃孵育12-16h。
2、1×SSC(含50%甲酰胺),50℃洗涤2次,每次10min。
3、2×SSC(含50%甲酰胺),37℃洗涤10min。
4、2×SSC(0.5ug/ml RNaseA),37℃洗涤30min。
5、1×SSC,50℃洗涤10min。
6、1×PBS(含0.1%Tween20),50℃洗涤2次,每次10min。
7、PBT室温洗涤10min。
8、封闭液处理1-1.5h。
9、加抗体(用封闭剂按1:500比例稀释),均匀地涂于切片表面,放于湿盒中,室温1-2h后4℃过夜(抗体1:500稀释于1×封闭液)。
10、PBT洗涤3次,每次15min。
11、显色缓冲液洗5min。
12、滴加显色液,黑暗中显色至适度。可在显微镜下多次观察。
13、显色终止液洗10min,双蒸水洗5次。
14、甲基绿(0.25%)滴加染色几秒中,双真水洗5min。
15、脱水封片。

三.注意事项
➤ 固定液的选择及固定时间
石蜡组织建议用10%中性缓冲福尔马林固定6~48h,其它固定液对实验结果可能产生一定的影响。组织离体后应尽快固定,建议在标本离体后30min内固定。如样本固定不及时,荧光信号会减弱。固定液的体积是组织体积的4~20倍,否则固定不充分,容易出现无信号或者信号很弱的现象。而且,为了保证信号的准确性,蜡块最好在2年内进行检测,已经切好的切片在6周内检测最佳。
➤ 组织切片和载玻片的选择
组织切片4~5μm 厚,过厚或过薄的切片均会对信号的强弱产生影响,而且切片应完整,质量良好,否则会在预处理时掉片。载玻片的选择建议使用防脱载玻片,有条件的实验室可使用更好的阳离子或者阴离子专用载玻片,可有效防止脱片现象的发生
➤ 实验过程中切片的预处理
切片预处理过程包括煮沸处理和蛋白酶消化。当组织处理不规范、切片过厚或烤片不足时,在煮沸过程中容易掉片,建议烤片温度在56℃过夜。煮沸过程中要严格控制实验温度和时间。酶消化是 FISH 实验的关键步骤之一,如果对组织不熟悉,可以先消化推荐的反应时间,然后复染 DAPI在荧光显微镜下观察,在DAPI通道下,以细胞既无空洞(消化过度),亦无明显的云雾状(消化不足)为最佳,同时可切换观察红绿通道,以红绿通道无明显的背景为佳,如果背景较高,可适当延长消化时间。另外,对于陈旧的石蜡组织切片,要适当延长消化时间,否则会出现大量的自发荧光。
➤ 变性和杂交
变性和杂交是本实验最关键的步骤,变性的时间和温度是杂交成功是否的关键,为保证变性期间温度的稳定,作者建议采用专业的原位杂交仪进行变性和杂交步骤,不仅能够减少实验的繁琐性,而且更有利于实验条件的控制,比如时间、温度和避光条件等。为避免杂交液在变性和杂交过程中的损失和防止干片,一定要在盖玻片的四周用橡胶水泥进行密封。
杂交后洗涤温度、时间和封片保存杂交后的洗涤对于整个实验结果的影响非常重要,首先应保证正确配置杂交洗涤液,洗涤液温度偏高或时间过长,可导致信号减弱,洗涤液温度偏低或者时间过短,会产生杂信号过多、红绿信号对比性差或者特异性低等情况。在复染完 DAPI 以后,加盖盖玻片,用指甲油固定住盖玻片四角,这样可以防止在油镜下观察时盖玻片脱落。由于荧光信号容易淬灭,所以在染色后应立即观察,如果当时不能观察,可将切片放入切片盒中,保存于-20℃冰箱里2周以内。 设置对照每次实验需设置标准对照: 实验室在每一轮检测中均应使用标准化对照材料( 阳性、阴性和可疑)。如果对照材料没有显示预期的结果,则不能对结果做出判定。
➤ 结果判读
应选择细胞核大小一致、核边界完整、DAPI染色均一、细胞核无重叠、信号清晰的细胞。随机计数至少20个浸润性癌细胞核中的双色信号。判读标准参考《乳腺癌 HER-2检测指南(2014版)》,对于FISH结果不确定的病例,需要再计算20个细胞核中的信号或由另外一位病理诊断医师重新计数。如仍为临界值,则应行免疫组化检测(若FISH检测前未行),也可以选取不同的组织块重新检测。
四、部分试剂配置
1 0.1mol/L三乙醇胺-0.25%乙酸酐:三乙醇胺13.2ml,氯化钠5g,浓盐酸4ml,DEPC水定容至约1000ml,临用前,一边摇动溶液一边加入乙酸酐2.5ml,充分混合。
2 10×PBS:氯化钠 80g,Na2HPO4·12H2O2 32.3g,NaH2PO4·2H2O2 4.5g。加DEPC水900ml,用HCl/NaOH调pH至7.2,最后定容为1000ml。
3 20×SSC(pH=7.0):氯化钠175.3g,枸橼酸钠88.2g,DEPC水(ddH2O)定容至1L。
4 100×Denhardts:Ficoll1g,PVP1g,BSA1g,DEPC水定容至50mL。
5 预杂交液:2×SSC,50%甲酰胺,100ug/ml变性鱼精DNA,5×Denhardts。
6 杂交液:2×SSC,50%甲酰胺,1×Denhardts,250μg/mL酵母tRNA或100μg/mL变性鱼精DNA,10mmol/L Tris-HC1 (pH7.5),0.5%SDS,5%葡聚糖硫酸酯,标记探针。
7 PBT:1×PBS,0.1%Triton×100,2mg/mL BSA使用前加入。
8 封闭液:0.1mol/L Tris-HCI pH7.5,0.15mol/L NaCI,0.5%羊血清或2%BSA。
9 显色缓冲液:100mmol/L Tris-HCI pH9.5,100mmol/L NaCI,50mmol/L MgCl2。
10 显色液:4.5μL/mL NBT,3.5μL/mL BCIP,用显色缓冲液配制。
11 显色终止液:0.1mol/L Tris-HCl pH8.0,10mmol/L EDTA。

