初代细胞培养实验
发布人:管理员 浏览次数: 发布时间:2018-05-29
初代培养或原代培养,是从供体获取组织后的首次培养。其最大优点是:组织和细胞刚刚离体,生物性状尚未发生很大的变化,具有二倍体遗传性状,在供体来源充分、生物条件稳定的情况下(年龄、性别),在一定程度上能 反 映体内状态。
实验方法原理
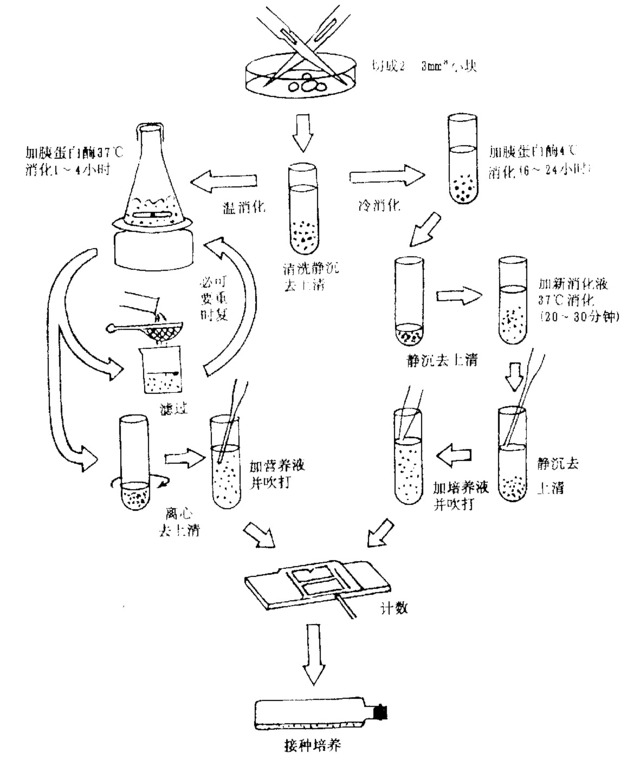
消化培养法
合成培养基胰蛋白酶消化培养法,能把组织块分散成细胞团或单个细胞,便于细胞从培养液中摄取营养和排出代谢产物,细胞能较快地长成单层。
本法尤适用于培养大量组织,细胞产量高;但用于经常性小量培养工作稍显繁琐,无菌操作不良时且易污染。
实验材料
试剂、试剂盒
仪器、耗材
吸管 平皿 培养瓶 烧杯 搅拌器 三角烧瓶 不锈钢筛 眼科剪 眼科镊 计数板
实验步骤
1. 准备
取各种已消毒的培养用品置于净化台面,紫外线消毒20 分钟;
2. 布局
点燃酒精灯(或煤气灯),安装吸管帽(应通过火焰);
3. 处理组织
把组织块置入烧杯中,用Hanks液漂洗2~3 次,去除血污;如怀疑组织可能污染,可先置于含有青链霉素的混合液中30~60 分钟;
4. 剪切
用眼科剪把组织块切成2~3 毫米大小的块(用手术刀割亦可),以便于消化;加入比组织块总量多30~50 倍的胰蛋白酶液,然后一并倒入三角烧瓶中,结扎瓶口或塞以胶塞;
5. 消化
或用恒温水浴,或置入37 ℃温箱消化均可,消化中每隔20 分钟应摇动一次,如用电磁恒温搅拌器消化更好(消化前瓶中需置一无菌搅棒);消化时间依组织块的大小和组织的硬度而定;
6. 分离
在消化过程中见消化液发混浊时,可用吸管吸出少许消化液在镜下观察,如组织已分散成细胞团或单个细胞,立即终止消化,随即通过适宜不锈钢筛,滤掉尚未充分消化开的组织块(必要时可继续进行消化);低速 (500~1000 转/分)离心消化液5 分钟,吸出上清,加入适量含有血清的培养液(如有其它酶或EDTA 等消化,需用Hanks液洗脱一两次后,再加入培养液);
7. 计数
用计数板计数,如细胞悬液细胞密度过大,再补加培养液调整后,分装入培养瓶中;对大多数细胞来说,pH 要求在7.2~7.4范围,培养液呈微红色,如颜色偏黄,说胆液体变酸,可用NaHCO3调整;
8. 培养
置入36.5 ℃温箱培养;如用CO2温箱培养,瓶口需用纱布棉塞或螺旋帽(松口)堵塞,纱布塞易生霉菌,每次换液时需更换新塞。
注意事项
1 组织块、胰蛋白酶、培养液等易受紫外线伤害的物品,最好在培养时再携入操作野;如预先置入,需用纸张覆盖,以免受射线影响;开始工作前先洗手、75%酒精擦拭手至肘部(工作时宜挽上袖口)
此文转载来源:丁香通
分享到:

