ELISA 实验操作,你知道多少呢?
发布人:管理员 浏览次数: 发布时间:2018-11-13
酶联免疫吸附(ELISA)可以:(1)免疫酶染色各种细胞内成份的定位;(2)研究抗酶抗体的合成;(3)显现微量的免疫沉淀反应;(4)定量检测体液中抗原或抗体成份。
实验原理
双抗体夹心法(常用于测定抗原)
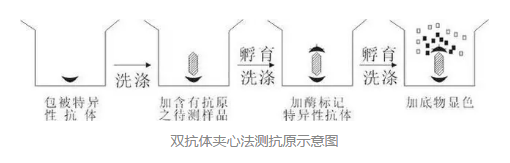
实验步骤
一、材料准备
1. 实验材料:血清、血浆、体液
2. 实验仪器:酶标比色计、96 孔板、移液枪、离心管、离心管盒
3. 所需试剂及试剂盒:碳酸盐包被缓冲液、抗体球蛋白、吐温-20、柠檬酸、硫酸
二、实验操作
1. 包被抗体:用包被缓冲液稀释特异性抗体球蛋白至最适浓度(1~10 μg /ml),每凹孔加 0.3 ml,4℃ 过夜,或 37℃ 水浴 3 小时,贮存冰箱。
2. 洗涤:移去包被液,凹孔用洗涤缓冲液(含 0.05% 吐温-20)洗 3 次,每次 5 分钟。
3. 每凹孔加入 0.2 ml 用稀释缓冲液稀释的含抗原的被检标本,37℃ 作用 1~2 小时。
4. 洗涤:移去包被液,凹孔用洗涤缓冲液(含 0.05% 吐温-20)洗 3 次,每次 5 分钟。
5. 加入 0.2 ml 用稀释缓冲液稀释的酶标记特异性抗体溶液,37℃ 作用 1~2 小时或由预试实验确定作用时间。
6. 洗涤:移去包被液,凹孔用洗涤缓冲液(含 0.05% 吐温-20)洗 3 次,每次 5 分钟。
7. 加入 0.2 ml 底物溶液于每个凹孔(OPD 或 OT),室温作用 30 分钟(另作一空白对照,0.4 ml 底物加 0.1 ml 终止剂)。
8. 加终止剂:每凹孔加 2M H2SO4 或 2 M 柠檬酸 0.05 ml。
9. 观察记录结果:目测或用酶标比色计测定(OPD 用 492 nm)OD 值。
ELISA 的影响因素
1. 固相载体
可溶性抗原或抗体吸附于固相载体而成为不溶形式,这是进行酶标记测定的基本条件。许多物质可作为固相载体,但在 ELISA 中最常用的是聚苯乙烯或聚氯乙烯微量反应板及塑料管。
每批制品在使用前,须经过实验室鉴定,鉴定的方法和标准是对每批购置的微量反应板或塑料管抽样,用 0.2 ug / ml 纯化的正常人 IgG 进行包被,经洗涤后加酶标记抗人球蛋白进行反应,再经孵育洗涤,加底物显色终止反应后,逐孔在酶标比色计中测定其消光值、光密度(OD 值)。
一般认为全板中每两孔间 OD 值的误差不超过 10% 为合格。如果中间孔与四周孔 OD 值相差太大,或者反应板的这一边与另一边凹孔的 OD 值相差大,均不合格。此外,还要检查阳性和阴性参考血清 OD 值是否有明显差别。一般要求有 10 倍左右的差异为合格。
2. 抗原
在 ELISA 中,包被于固相载体表面的抗原或抗体的来源和制备方法对试验结果都有影响。包被所用的抗原必须是可溶性的,且要求是优质和稳定的制剂,纯度和免疫原性要高。而且抗原包被固相载体除浓度外,对时间、温度、PH 均有关系。
温度高(如 37℃、45℃、或 56℃),包被时间可缩短,温度低可延长包被时间。但为了方便起见,通常采用 4℃ 包被过夜,可使抗原吸附得更加完全且均匀。
在用聚苯乙烯或聚乙烯微量反应板或塑料管作固相载体时,在碱性条件下(如 0.1 mol/L、PH 9.6 碳酸盐缓冲液稀释抗原)4℃ 包被过夜较为合适。
但在某些试验中,如用 LPS 或毒素蛋白包被时,用 PH 7.2~7.4 PBS 稀释才是满意的。包被特异蛋白质的浓度为 1~10 ug/ml,而对某些病原微生物抗原以 5~20 ug/ml 较为合适,但均应通过滴定。
本文来自丁香园
分享到:

