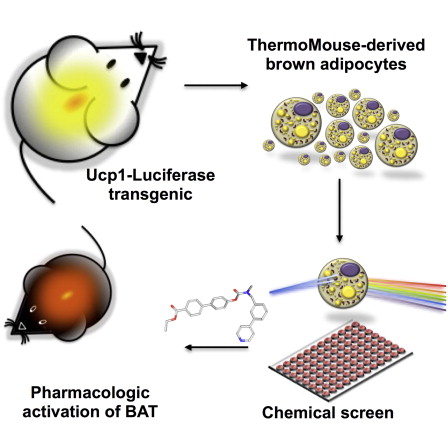
在2009年,研究人员发现,成年人有 “好”的脂肪类型:燃烧卡路里的棕色脂肪组织。棕色脂肪燃烧能量的这种能力,其关键是解偶联蛋白1(UCP1)——一种独特的蛋白质,以热的形式消耗能量。目前,一组科学家制备了一种叫做ThermoMouse的遗传小鼠模型,可让他们在活体动物内随时间推移可视化UCP1的活动,从而可视化棕色脂肪。
当UCP1表达时,这一新的小鼠模型表达荧光素酶。这一新工具,连同来自小鼠的一个UCP1荧光素酶棕色脂肪细胞系,发表在最近一期的《Cell Reports》杂志,可以帮助研究人员检测潜在的肥胖治疗法(通过打开棕色脂肪),或更好地了解与其活化相关的分子通路。
当研究人员筛选出可能引发UCP1表达的化合物时,他们提出了几个靶点。其中一个是WWL113,可增强肥胖小鼠的胰岛素敏感性和糖耐量。当研究人员给小鼠服用WWL113时,发现它没有单独地增加能量消耗,但是当与去甲肾上腺素一起服用时会发生这种情况。这些研究结果发表在去年2月份的《Nature Chem Biol》杂志。
本文共同通讯作者、斯克里普斯研究所的Enrique Saez 称:“关于这些化合物(简单地增加UCP1表达的水平)是否真正起作用,有很多的争议,因为它们需要额外的刺激。我们在这里所看到的是,至少用这一种化合物时,情况确实如此。”
“米色”脂肪细胞,是存在于白色脂肪的一种不同类型的脂肪细胞,是用于治疗肥胖的另一个潜在靶点。当UCP1是活跃时,ThermoMouse也在米色脂肪中表达荧光素酶,因此科学家们正致力于制备米色细胞系,想在这些细胞中可视化UCP1的表达。
Saez说:“我们希望能够确定在米色细胞中起作用的化合物,因为在人类中没有太多的棕色脂肪,但是招募和提高米色细胞的活性,大有潜力”。
Saez带领的研究小组,很乐意与其他科研机构的研究人员分享他们的细胞系和小鼠模型。鉴于对ThermoMouse的需求很多,科学家已经将其提交给Jackson实验室(世界最著名的小时候研究中心,为世界各国实验室提供特殊品系的小鼠)。
原文链接:ThermoMouse: An In Vivo Model to Identify Modulators of UCP1 expression in Brown Adipose Tissue
Obesity develops when energy intake chronically exceeds energy expenditure. Because brown adipose tissue (BAT) dissipates energy in the form of heat, increasing energy expenditure by augmenting BAT-mediated thermogenesis may represent an approach to counter obesity and its complications. The ability of BAT to dissipate energy is dependent on expression of mitochondrial uncoupling protein 1 (UCP1). To facilitate the identification of pharmacological modulators of BAT UCP1 levels, which may have potential as antiobesity medications, we developed a transgenic model in which luciferase activity faithfully mimics endogenous UCP1 expression and its response to physiologic stimuli. Phenotypic screening of a library using cells derived from this model yielded a small molecule that increases UCP1 expression in brown fat cells and mice. Upon adrenergic stimulation, compound-treated mice showed increased energy expenditure. These tools offer an opportunity to identify pharmacologic modulators of UCP1 expression and uncover regulatory pathways that impact BAT-mediated thermogenesis.

