将指数生长期的细胞暴露在细胞毒性药物中,暴露的持续时间通常决定于产生最大损伤所需的时间,但是它也受药物稳定性的影响。将药物撤除后,让细胞再增殖 2?3 个群体倍增时间(PDT ),这样就可以把能够增殖的存活细胞与那些不能增殖的存活细胞区別开来。然后用M T T 染料还原反应测定存活细胞的数目。只要MTT—甲臜产物溶于适当溶剂中,就可以用分光光度法来定量。
实验方法原理
将指数生长期的细胞暴露在细胞毒性药物中,暴露的持续时间通常决定于产生最大损伤所需的时间,但是它也受药物稳定性的影响。将药物撤除后,让细胞再增殖 2~3 个群体倍增时间(PDT ),这样就可以把能够增殖的存活细胞与那些不能增殖的存活细胞区別开来。然后用 MTT 染料还原反应测定存活细胞的数目。只要 MTT—甲臜产物溶于适当溶剂中,就可以用分光光度法来定量。
先将不同浓度的药物加入到微滴定板上培养的单层细胞中温育(图 22.5), 撤去药物,每日换液至 2~3 个 PDT , 然后再次更换培养液并在每个孔中加入 MTT。于暗处温育 4 h ,然后撤除培养基和 MTT 。将不溶于水的 MTT—甲臜结晶溶于 DMSO 中,加人缓冲液调节最终的 pH , 在 ELISA 读板仪上记录吸光值.
实验步骤
材料:
无菌
生长液:
胰蛋白酶(0.25% + EDTA ,1 mmol/L ,溶于 PBSA 中)
MTT : 3-(4,5-二甲基-2-噻唑)-2, 5-二甲苯基溴化四唑,50 mg/m l, 滤过, 除菌。
Sorensen 甘氨酸缓冲液(0.1 mol/L 甘氨酸,0.1 mol/L, NaC l,用 1 mol/L Na(OH) 将 pH 调至 10.5)
微滴定板(Iwaki)
微量吸头,最好放在高压灭菌的吸头盒中
5 cm 和 9 cm 培养皿(未经 T C 处理的)或储液器(Corning)
30 ml 和 100 ml 通用容器或试管

非灭菌
塑料盒(无毒的聚苯乙烯,装培养板用)
多道加样器
二甲基亚砜 (DMSO) DMS( ) 分装器:Labsystems Microplate Dispenser (Cat No 5840127,Thermo Electron)
ELISA 读板仪(Molecular Devices,with SOFT max PRO ; 见附录Ⅱ )
离心用的板架(用于悬浮生长的细胞)
操作步骤
接种细胞
1. 用胰蛋白酶消化汇合的单层细胞,将细胞收集到含血清的培养基中。
2. 离心细胞悬液(5 min ,200 g ),使细胞沉积下来。用培养基重悬细胞,计数。
3. 将细胞稀释至 2.5 X103~50 X103 个/ml,这要依细胞系的生长速度而定,每个微滴定板可以容纳 20 ml 细胞悬 液。
4. 将细胞悬液移至 9 cm 培养皿中,用多道加样器在平底 96 孔板中间 10 列的各孔中加人 20 μl 细胞悬液(每板 80 孔),从第 2 列开始到第 11 列为止,每孔加入 0.5X 103~10X 103 个细胞
5. 将 200μl 培养基加至第 1 列与第 12 列的 8 个孔中。第 1 列用作读板仪的空白对照,第 12 列有助于维持第 11 列的湿 度,并将「边缘效应」(edge effect) 减至最小。
6. 将培养板放至塑料饭盒中,于 37℃:湿润环境中温育 1~3 d ,等细胞进入指数生长期时可加入药物。
7. 对于非黏附细胞,用新鲜培养基制备细胞悬液,将细胞稀释至每毫升 5X 103~100X 103 个/m l,仅取 100 μl 细胞 悬液接种于圆底 96 孔板,之后立即加入药物。
添加药物
8. 用培养基将细胞毒性药物 5 倍系列稀释,共制备 8 个浓度。选择浓度时应以最高浓度下多数细胞被杀死,而最低 浓度时不会杀死细胞为标准。只要对药物的毒性有所了解,便可采用较小的浓度范围。一般情况下,每种药物使 用 3 块培养板,这样一次试验中可以有三个平行测定结果。
9. 对于贴壁生长的细胞,去除第 2?11 列各孔中的培养基,这可以通过将皮下注射器针连在吸引管上完成。
10. 在第 2 列和第 11 列的 8 个孔中加人 200^1 新鲜配制的培养基,这些细胞作为对照。
11. 在第 3~10 列的细胞中加入细胞毒性药物。每个药物浓度仅需 4 个孔,这样 A ?D 行可用于第一种药物,E ~H 行用于第二种药物。
12. 将药物溶液移至 5 cm 培养皿中,用 4 道加样器向每组的 4 个孔中各加入 200 μl。
13. 将培养板放回塑料盒中,温育至确定的暴露时间。对于非黏附细胞,将药 物稀释至预期终浓度的 2 倍,取 100^1 加入已含 100^1 细胞的孔中。
生长期
14. 在药物暴露期结束时,去除所有含有细胞的孔中的培养基,加入 200 μl 新鲜的培养基。若是非黏附细胞,离心培 养板(5 min ,200 g ),使细胞沉淀下来。然后用细针头吸去培养基,不要扰动细胞团。
15. 每日换液至 2~3 个 P D T 。
存活细胞数的估算
16 . 在生长期末,每孔中各加人 200 μl 新鲜的培养基,在第 1?11 列所有孔中各加人 50 μl MTT 。
17. 以铝箔包裹培养板,于 37°C 湿润环境中温育 4 h 。请注意 4 h 是所需的最短温育时间,可延至 8 h 。
18.. 弃去孔中的培养基和 (非黏附细胞则离心),在第 1?11 列所有孔中各加入 200μl DMSO , 以溶解残留的 M T T - 甲腊结晶。
19. 在含 DMSO 的各孔中加人甘氨酸缓冲液(每孔 25 μl )。
20. 立即在 570 nm 处记录吸光值,因为产物不稳定。读板仪用第 1 列中含培养基和 MTT 但不含细胞的各孔调零。
MTT 试验分析
21. 以药物浓度为横坐标(X 轴),吸光值为纵坐标(Y 轴)绘制曲线图。
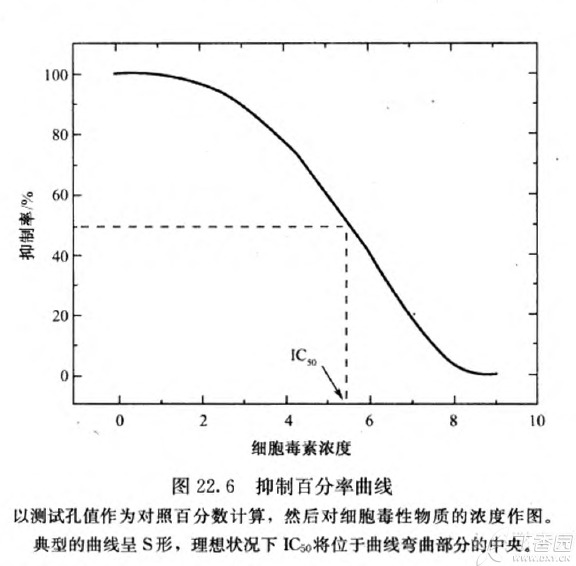
22. 第 2 列和第 11 列各孔中得出的平均吸光值作为对照吸光值,对照组吸光值减少一半时所需的药物浓度为 IC50 浓 度。偶尔结果并非如此,这表明整个板中所接种的细胞数不一致之故。
23. 得到吸光值的绝对值,以此作图,这样才能与对照吸光值比较,然后要将数据转化成百分率抑制曲线 (图 22.6), 从而使一系列曲线标准化。
来源:丁香通

