PCR扩增后的产物往往需要克隆到载体中,传统的PCR产物克隆方法不外乎以下两种:
1.PCR引物设计时引入载体上的酶切位点,PCR产物经双酶切后定向克隆到目的载体上。这种方法的优点是定向连接克隆,筛选方便。缺点则是PCR产物的酶切和判断比较困难,另外酶切连接过程本身也相当的费时费力。PCR引物设计时在两端引入酶切位点,由于部分限制性内切酶在酶切过程中需要在识别位点两端留有一定长度的“空间”,有的时候识别位点两端的碱基序列都会显著影响酶切效率,PCR引物设计如果不能满足这些条件会导致两个末端双酶切不完全甚至不能酶切而造成最后连接失败。另外由于PCR产物两边末端的双酶切只是减少了几个碱基,酶切与否很难用常规的电泳检测出来,往往连接失败还找不到原因。这个过程非常折磨人,所以很多人喜欢方法2 。
2. T载体连接。由于普通Taq酶扩增得到的PCR产物带有A末端,可以用带有T末端突出的T载体直接连接。这个方法比较简便,不需要经过双酶切,对引物设计也没有要求。但是缺点也很明显——需要单独购买T载体;连接效率不高而且连接时间长,由于非定向克隆,后继筛选比较麻烦;最令人痛苦的是——由于要购买T载体而不能自由使用自己需要的载体,挑出正确的重组子后面还必须要再多一次亚克隆——将DNA片断转移到自己需要的载体上。虽然有很多办法可以大大缩短T载体连接时间和提高连接效率,比如快速连接试剂盒,以及Topo克隆技术,但都未能解决非定向克隆和需要多一次亚克隆的问题。
In-Fusion™ PCR Cloning Kits为PCR产物克隆揭开全新的篇章——这个设计巧妙的产品操作简单方便,不需要借助任何限制性内切酶、连接酶、或者磷酸化、补平末端等手段,就可以在30分钟内,将任何PCR产物片断精确地定向克隆到任何你想要的载体上,克隆的位置不受酶切位点的限制!而且可以适用于各种规模,特别是高通量的实验。所有的工作仅仅是温育30分钟然后转化!真正一步解决PCR克隆的所有技术上的烦恼。

·适用于各种自备载体、插入片断、或者酶切位点
·只要线性化载体就行(单酶切、双酶切均可),不用酶切PCR产物,不用补平末端
·不用去磷酸化载体,不用连接
·适用于各种PCR酶(常规Taq、各种高保真酶均可)的扩增产物
·混合温育30分钟即可转化,节约时间和精力
·精确定向克隆,即使载体单酶切也可以定向
·表达产物没有多余的氨基酸
·重组效率高、转化率高
·重复性高、可靠性好——可用于高通量操作,批量克隆
·根据实验需要选择适合的表达载体,选择最佳酶切位点,酶切载体得到线性化载体(单酶切或者双酶切均可)
In-Fusion技术的最大优点就是对载体没有特别要求,任何自备的载体都可以使用。这样就方便用户一步就将PCR产物克隆到自己的表达载体上,不需要T载体那样的中间载体,也不需要重复的亚克隆。仅此一点就可以为使用者节约不少时间和精力了。
此外,In-Fusion技术对载体上的酶切位点也没有特殊的要求,用户可以自由地选择最佳酶切位点,不需要迁就读码框架也不会给目的基因带来多余的碱基,非常自由。
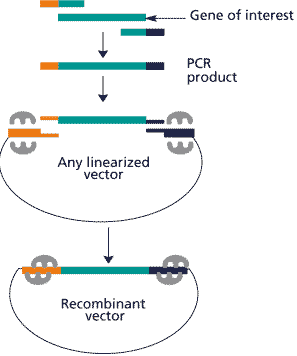
·根据线性化载体两端序列,在PCR引物设计中分别引入15个碱基的载体末端序列,使得PCR引物“外侧”带有15个碱基,分别和载体两端序列相同。
这一步是关键的一步。PCR两端引物设计时,在目的基因同源序列的两侧分别加入了线性化载体两端各15个碱基,PCR得到的产物两端就分别带上了15个和载体末端重复的序列。无论载体用什么酶线性化,无论是5’突出、3’突出或者平末端,都只要根据线性化的载体5’末端往前数15个碱基设计即可(如图)。虽然合成引物时比平时多了几个碱基,不过考虑后面的方便和节约省事,还是很值得的。

·得到的PCR产物和线性化载体,加入In-Fusion专利酶,混合,25度保温30分钟后转化,就可以高效、精确、定向将PCR产物克隆到目标载体上。
由于PCR产物和线性化载体的末端同源,加入专利的In-Fusion专利酶就可以实现类似同源重组的反应,将PCR产物“置换”到目标载体上。
由于PCR产物两个末端序列不同(即使载体是单酶切,载体两个末端的4—5个相同,识别位点以外的其他碱基也会有所不同),这种类似重组的反应是精确定向的,不需要检验插入片断的方向。因此可以为使用人节约不少时间和精力。
由于不需要连接酶,转化结果的重组率和转化效率都非常令人满意。看看下图中密密麻麻的转化子和检测插入片断的结果(随机挑选96个克隆中有94正确插入),实在是太爽了。

下图给出一些实验结果证实这个技术能够适用于各种载体,不同大小的载体、不同大小的插入片断,不同的酶切位点,都能高效克隆。

灵活可靠,可用于大规模高通量(high-throughput)PCR产物克隆
现代PCR产物可以大规模高通量进行,但是PCR产物克隆传统方法并不适用于高通量筛选。In-Fusion技术由于简单、精确、定向、结果可靠、稳定性高,已经证实可以用于大规模高通量克隆。包括哈佛医学院蛋白质组研究中心(Institute of Proteomics at Harvard Medical School)和RZPD (Germany), MRC Gene Services (UK)几个大型机构在内已经采用这个技术,用高通量的方法成功克隆了数千个基因。尽管插入片断大小从500到5500bp不等,批量克隆PCR产物依然保持了平均高达90%的成功率。实际上,实验结果表明,10kb大小的PCR产物片断也能够有效的克隆到需要的载体上,而且每个实验仅需要纳克级别的PCR产物和线性化载体就已经足够。毫无疑问,In-Fusion技术在高通量领域的应用也为大规模、高速克隆基因提供了极大的方便,可谓PCR克隆的里程碑式的新突破。
原来的试剂盒提供了专利的In-Fusion酶和Buffer、BSA,以及一个pDNR-Dual载体、一个对照用的插入片断。新版的试剂盒更为方便——In-Fusion酶、Buffer、BSA等全部反应组分已经配好、分装到小指管(8个一条的PCR管)中并冻干,使用时只需要加入PCR产物和线性化载体,加ddH2O补充够10ul体积就可以了!实在是方便之极。冻干的组分可以在室温下至少保存半年,不用担心冷藏运输条件的影响,最大程度保证使用者的使用效果。
试剂盒提供的对照载体是pDNR-Dual载体,本身是Creater系列的入门载体,基因克隆到这个载体后可以不用酶切连接就直接亚克隆到这个系列其他不同的表达载体中,可以非常简单的实现在不同的表达系统中表达同一个基因的目的。也是一个很有用的载体呢。
