这种技术是把电泳分离的组分从凝胶转移到一种固相支持体,并以针对特定氨基酸序列的特异性试剂作为探针检测之。Western使用的探针是抗体,它与附着于固相支持体的靶蛋白所呈现的抗原表位发生特异性反应。这种技术的作用是对非放射性标记蛋白组成的复杂混合物中的某些特异蛋白进行鉴别和鉴定。
仪器:高压锅、玻璃匀浆器、高速离心机、分光光度仪、—20℃低温冰箱、垂直板电泳转移装置、恒温水浴摇床、多用脱色摇床。
试剂:单去污剂裂解液、0.01mol/L PBS (pH7.3)、10%分离胶、4%浓缩校、G250考马斯亮蓝溶液、0.15mol/L NaCl 溶液、2X(5X)SDS上样缓冲液、电泳缓冲液、转移缓冲液、10X丽春红染液、封闭液、TBST、TBS、洗脱抗体缓冲液、显影液、定影液、抗体、化学发光试剂。
杂品与耗材:各种规格的吸头、离心管和加样器;各种规格的烧杯、量筒和平皿等玻璃器材;硝酸纤维素膜,乳胶手套,保鲜膜,搪瓷盘(>20×20cm),X-光片夹,X-光片,玻棒长短各一根,计时器,吸水纸。
试剂配制:
(一)母液
1.0mol/L Tris·HCl
Tris (MW121.14) 30.29g
蒸馏水 200ml
溶解后,用浓盐酸调 pH 至所需点(见下所示),最后用蒸馏水定容至 250ml,高温灭菌后室温下保存。
PH HCl
7.4 约 17ml
7.5 约 16m
7.6 约 15ml
8.0 约 10ml
1.74mg/ml (10mmol/L)PMSF
PMSF 0.174g
异丙醇 100ml
溶解后,分装于 1.5ml 离心管中,-20℃保存。
0.2mol/L NaH2PO4
NaH2PO4(MW119.98) 12g
蒸馏水至 500ml 溶解后,高压灭菌,室温保存。
0.2mol/LNa2HPO4
Na2HPO4·12H2O(MW 358.14) 71.6g
蒸馏水至 1000ml溶解后,高压灭菌,室温保存。
10%SDS
SDS 10g
蒸馏水至 100ml50℃水浴下溶解,室温保存。如在长期保存中出现沉淀,水浴溶化后,仍可使用。
10%过硫酸胺(AP)
过硫酸胺 0.1g
超纯水 1.0ml溶解后,4℃保存,保存时间为 1 周。
1.5mol/L Tris·HCl(pH8.8)
Tris (MW121.14) 45.43g
超纯水 200ml溶解后,用浓盐酸调 pH 至 8.8,最后用超纯水定容至 250ml,高温灭菌后室温下保存。
0.5mol/L Tris·HCl(pH6.8)
Tris (MW121.14) 15.14g
超纯水 200ml溶解后,用浓盐酸调 pH 至 6.8,最后用超纯水定容至 250ml,高温灭菌后室温下保存。
40%Acr/Bic(37.5:1)
丙稀酰胺(Acr) 37.5g
甲叉双丙稀酰胺(Bic) 1g
超纯水至 100ml37℃下溶解后,4℃保存。使用时恢复至室温且无沉淀。
20%Tween20
Tween20 20ml
蒸馏水至 100ml混匀后 4℃保存。
单去污剂裂解液(50mmol/L Tris·HCl pH8.0,150mmol/L NaCl,1%TritonX-100,100μg/ml PMSF):
1mol/L Tris·HCl(pH8.0) 2.5ml
NaCl 0.438g
TritonX-100 0.5ml
蒸馏水至 50ml混匀后, 4℃保存。使用时,加入 PMSF 至终浓度为 100μg/ml(0.87ml 裂解液加入 1.74mg/ml PMSF50μl)。
0.01mol/L PBS( pH 7.2-7.4)
0.2 mol/L NaH2PO4 19ml
0.2 mol/L Na2HPO4 81ml
NaCl 17g
蒸馏水至 2000mlG250 考马斯亮蓝溶液(测蛋白含量专用)
考马斯亮蓝 G250: 100mg
95%乙醇: 50ml
磷酸: 100ml
蒸馏水至 1000ml配制时,先用乙醇溶解考马斯亮蓝染料,再加入磷酸和水,混匀后,用滤纸过滤,4℃保存。
0.15 mol/L NaCl
NaCl(MW58.44) 0.877g
蒸馏水至 100 ml高温灭菌后,室温保存。
100mg/ml 牛血清白蛋白(BSA)
BSA 0.1g
0.15 mol/L NaCl 1ml
溶解后,-20℃保存。制作蛋白标准曲线时,用 0.15 mol/L NaCl 进行 100 倍稀释成 1mg/ml,-20℃保存。
10%分离胶和 4%浓缩校
10%分离胶(两块胶,10ml) 4%浓缩胶(两块胶,5ml)
超纯水 4.85ml 3.16ml
40%Acr/Bic(37.5:1) 2.5ml 0.5ml
1.5 mol/L Tris·HCl(pH8.8) 2.5ml -
0.5 mol/L Tris·HCl(pH6.8) - 1.26ml
10%SDS 100 μl 50 μl
10%AP(过硫酸胺) 50 μl 25 μl
TEMED 5 μl 5 μl
加 TEMED 后,立即混匀即可灌胶。
还原型 5XSDS 上样缓冲液(0.25mol/L Tris·HCl pH6.8,0.5mol/L 二硫叔糖醇,10% SDS,0.5%溴酚蓝,50%甘油)
0.5 mol/L Tris·HCl(pH6.8) 2.5ml
二硫叔糖醇(DTT,MW154.5) 0.39g
SDS 0.5g
溴酚蓝 0.025
甘油 2.5ml
混匀后,分装于 1.5ml 离心管中,4℃保存。
电泳液缓冲液(25mmol/L Tris,0.25mol/L 甘氨酸,0.1% SDS)
Tris(MW121.14) 3.03g
甘氨酸(MW75.07) 18.77g
SDS 1g
蒸馏水至 1000ml溶解后室温保存,次溶液可重复使用 3~5 次。转移缓冲液(48mmol/L Tris,39mmol/L 甘氨酸,0.037% SDS,20%甲醇)
甘氨酸(MW75.07) 2.9g
Tris(MW121.14) 5.8g
SDS 0.37g
甲醇 200ml
蒸馏水至 1000ml溶解后室温保存,次溶液可重复使用 3~5 次。
10X 丽春红染液
丽春红 S 2g
三氯乙酸 30g
磺基水杨酸 30g
蒸馏水至 100ml 使用时将其稀释 10 倍。
TBS 缓冲液(100mmol/ L Tris·HCl pH7.5,150mmol/L NaCl)
1 mol/ LTris·HCl(pH7.5) 10ml
NaCl 8.8g
TBST 缓冲液(含 0.05%Tween20 的 TBS 缓冲液)
20%Tween20 1.65ml
TBS 700ml
混匀后即可使用,最好现用现配。
封闭液(含 5%脱脂奶粉的 TBST 缓冲液)
脱脂奶粉(国产,安怡牌) 5g
TBST 100ml
溶解后 4℃保存。使用时,恢复室温,用量以盖过膜面即可,一次性使用。
洗脱抗体缓冲液(100mmol/L 2-Mercaptoethanol,2%SDS,62.5m mol/L Tris·HCl pH6.8)
14.4 mol/L 2- Mercaptoethanol(β-巯基乙醇) 700 μl(通风厨里加)
SDS 2g
0.5mol/L Tris·HCl(pH6.8) 12.5ml
超纯水至 100ml
配制时,在通风厨内进行。4℃保存。可重复使用 1 次。
自来水(加热至 50℃) 375ml (以下药品加到温水中)
米吐尔 1.55g
亚硫酸钠(无水) 22.5g
碳酸钠(无水) 33.75g
溴化钾 20.95g
补水至 500ml
配制时,上述药品应逐一加入,待一种试剂溶解后,再加入后一种试剂。4℃保存。使用时用自来水稀释至 1 倍。
定影液
自来水(50~60℃) 700ml (以下药品按顺序加入前者溶解后再加后者)
硫代硫酸钠 240g
亚硫酸钠(无水) 15g
冰乙酸 12.6ml
硼酸 7.5g
钾明矾 15g(水温冷至 30℃以下时再加入)
加水定容至 1000ml,室温保存
抗体
用 TBST 稀释至一定浓度使用,每张膜需 0.5ml
化学发光试剂
购自北京中山公司,为 Santa Cruz 产品,分 A 和 B 两种试剂。
操作步骤:
(一) 蛋白样品制备
(1) 单层贴壁细胞总蛋白的提取:
1、 倒掉培养液,并将瓶倒扣在吸水纸上使吸水纸吸干培养液(或将瓶直立放置一会儿使残余培养液流到瓶底然后再用移液器将其吸走)。
2、 每瓶细胞加 3ml 4℃预冷的 PBS(0.01M pH7.2~7.3)。平放轻轻摇动 1min 洗涤细胞,然后弃去洗液。重复以上操作两次,共洗细胞三次以洗去培养液。将PBS 弃净后把培养瓶置于冰上。
3、 按 1ml 裂解液加 10 μl PMSF(100mM),摇匀置于冰上。(PMSF 要摇匀至无结晶时才可与裂解液混合。)
4、 每瓶细胞加 400 μl 含 PMSF 的裂解液,于冰上裂解 30min,为使细胞充分裂解培养瓶要经常来回摇动。
5、 裂解完后,用干净的刮棒将细胞刮于培养瓶的一侧(动作要快),然后用枪将细胞碎片和裂解液移至 1.5ml 离心管中。(整个操作尽量在冰上进行。)
6、 于 4℃下 12000rpm 离心 5min。(提前开离心机预冷)
7、 将离心后的上清分装转移倒 0.5min 的离心管中放于-20℃保存。
(2) 组织中总蛋白的提取:
1、 将少量组织块置于 1~2ml 匀浆器中球状部位,用干净的剪刀将组织块尽量剪碎。
2、 加 400 μl 单去污剂裂解液裂(含 PMSF)于匀浆器中,进行匀浆。然后置于冰上。
3、 几分钟后再碾一会儿再置于冰上,要重复碾几次使组织尽量碾碎。
4、 裂解 30 min 后,即可用移液器将裂解液移至 1.5ml 离心管中,然后在 4℃下12000rpm 离心 5min,取上清分装于 0.5ml 离心管中并置于-20℃保存。
(3) 加药物处理的贴壁细胞总蛋白的提取:
由于受药物的影响,一些细胞脱落下来,所以除按(一)操作外还应收集培养液中的细胞。以下是培养液中细胞总蛋白的提取:
1、 将培养液倒至 15ml 离心管中,于 2500rpm 离心 5min。
2、 弃上清,加入 4ml PBS 并用枪轻轻吹打洗涤,然后 2500rpm 离心 5min。弃上清后用 PBS 重复洗涤一次。
3、 用枪洗干上清后,加 100 μl 裂解液(含 PMSF)冰上裂解 30min,裂解过程中要经常弹一弹以使细胞充分裂解。
4、 将裂解液与培养瓶中裂解液混在一起 4℃、12000rpm 离心 5min,取上清分装于 0.5ml 离心管中并置于-20℃保存。
(二) 蛋白含量的测定
(1) 制作标准曲线
1、 从-20℃取出 1mg/ml BSA,室温融化后,备用。
2、 取 18 个 1.5ml 离心管,3 个一组,分别标记为 0μg,2.5μg,5.0μg ,10.0μg ,20.0μg ,40.0μg。
3、 按下表在各管中加入各种试剂。
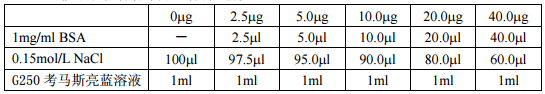
4、 混匀后,室温放置 2min。在生物分光光度计(Bio-Photometer,Eppentoff)上比色分析。
5、
(2) 检测样品蛋白含量
3、 弃空白样品,用无水乙醇清洗比色杯 2 次(每次 0.5ml),再用无菌水洗一次。
4、 取一管考马斯亮蓝加 95 μl 0.15mol/L NaCl NaCl 溶液和 5μl 待测蛋白样品,混匀后静置 2min,倒入扣干的比色杯中按 sample 键测样品。
注意:每测一个样品都要将比色杯用无水乙醇洗 2 次,无菌水洗一次。可同时混合好多个样品再一起测,这样对测定大量的蛋白样品可节省很多时间。测得的结果是 5 μl 样品含的蛋白量。
(三) SDS-PAGE 电泳
(1) 清洗玻璃板:
一只手扣紧玻璃板,另一只手蘸点洗衣粉轻轻擦洗。两面都擦洗过后用自来水冲,再用蒸馏水冲洗干净后立在筐里晾干。
(2) 灌胶与上样
1、 玻璃板对齐后放入夹中卡紧。然后垂直卡在架子上准备灌胶。(操作时要使两玻璃对齐,以免漏胶。)
2、 按前面方法配 10%分离胶,加入 TEMED 后立即摇匀即可灌胶。灌胶时,可用 10ml 枪吸取 5ml 胶沿玻璃放出,待胶面升到绿带中间线高度时即可。然后胶上加一层水,液封后的胶凝的更快。(灌胶时开始可快一些,胶面快到所需高度时要放慢速度。操作时胶一定要沿玻璃板流下,这样胶中才不会有气泡。加水液封时要很慢,否则胶会被冲变型。)
3、 当水和胶之间有一条折射线时,说明胶已凝了。再等 3min 使胶充分凝固就可倒去胶上层水并用吸水纸将水吸干。
4、 按前面方法配 4%的浓缩胶,加入 TEMED 后立即摇匀即可灌胶。将剩余空间灌满浓缩胶然后将梳子插入浓缩胶中。灌胶时也要使胶沿玻璃板流下以免胶中有气泡产生。插梳子时要使梳子保持水平。由于胶凝固时体积会收缩减小,从而使加样孔的上样体积减小,所以在浓缩胶凝固的过程中要经常在两边补胶。待到浓缩胶凝固后,两手分别捏住梳子的两边竖直向上轻轻将其拔出。
5、 用水冲洗一下浓缩胶,将其放入电泳槽中。(小玻璃板面向内,大玻璃板面向外。若只跑一块胶,那槽另一边要垫一块塑料板且有字的一面面向外。)
6、 测完蛋白含量后,计算含 50μg 蛋白的溶液体积即为上样量。取出上样样品至 0.5ml 离心管中,加入 5×SDS 上样缓冲液至终浓度为 1×。(上样总体积一般不超过 15μl,加样孔的最大限度可加 20μl 样品。)上样前要将样品于沸水中煮 5min 使蛋白变性。
7、 加足够的电泳液后开始准备上样。(电泳液至少要漫过内测的小玻璃板。)用微量进样器贴壁吸取样品,将样品吸出不要吸进气泡。将加样器针头插至加样孔中缓慢加入样品。(加样太快可使样品冲出加样孔,若有气泡也可能使样品溢出。加入下一个样品时,进样器需在外槽电泳缓冲液中洗涤3 次,以免交叉污染。
(3) 电泳
电泳时间一般 4~5 h,电压为 40V 较好,也可用 60V。电泳至溴酚兰刚跑出即可终止电泳,进行转膜。
(四) 转膜
(1) 转一张膜需准备 6 张 7.0~8.3cm 的滤纸和 1 张 7.3~8.6cm 的硝酸纤维素膜。切滤纸和膜时一定要戴手套,因为手上的蛋白会污染膜。将切好的硝酸纤维素膜置于水上浸 2 h 才可使用。(用镊子捏住膜的一边轻轻置于有超纯水的平皿里,要使膜浮于水上,只有下层才与水接触。这样由于毛细管作用可使整个膜浸湿。若膜沉入水里,膜与水之间形成一层空气膜,这样会阻止膜吸水。
(2) 在加有转移液的搪瓷盘里放入转膜用的夹子、两块海绵垫、一支玻棒、滤纸和浸过的膜。
(3) 将夹子打开使黑的一面保持水平。在上面垫一张海绵垫,用玻棒来回擀几遍以擀走里面的气泡。(一手擀另一手要压住垫子使其不能随便移动。)在垫子上垫三层滤纸(可三张纸先叠在一起在垫于垫子上),一手固定滤纸一手用玻棒擀去其中的气泡。
(4) 要先将玻璃板撬掉才可剥胶,撬的时候动作要轻,要在两个边上轻轻的反复撬。撬一会儿玻璃板便开始松动,直到撬去玻板。(撬时一定要小心,玻板很易裂。)除去小玻璃板后,将浓缩胶轻轻刮去(浓缩胶影响操作),要避免把分离胶刮破。小心剥下分离胶盖于滤纸上,用手调整使其与滤纸对齐,轻轻用玻棒擀去气泡。将膜盖于胶上,要盖满整个胶(膜盖下后不可再移动)并除气泡。在膜上盖 3张滤纸并除去气泡。最后盖上另一个海绵垫,擀几下就可合起夹子。整个操作在转移液中进行,要不断的擀去气泡。膜两边的滤纸不能相互接触,接触后会发生短路。(转移液含甲醇,操作时要戴手套,实验室要开门以使空气流通。)
(5) 将夹子放入转移槽槽中,要使夹的黑面对槽的黑面,夹的白面对槽的红面。电转移时会产热,在槽的一边放一块冰来降温。一般用 60V 转移 2 h 或 40V 转移3 h。
(6) 转完后将膜用 1×丽春红染液染 5min(于脱色摇床上摇)。然后用水冲洗掉没染上的染液就可看到膜上的蛋白。 将膜晾干备用。
(五) 免疫反应
(1) 将膜用 TBS 从下向上浸湿后,移至含有封闭液的平皿中,室温下脱色摇床上摇动封闭 1h。
(2) 将一抗用 TBST 稀释至适当浓度(在 1.5ml 离心管中);撕下适当大小的一块儿保鲜膜铺于实验台面上,四角用水浸湿以使保鲜膜保持平整;将抗体溶液加到保鲜膜上;从封闭液中取出膜,用滤纸吸去残留液后,将膜蛋白面朝下放于抗体液面上,掀动膜四角以赶出残留气泡;室温下孵育 1~2h 后,用 TBST 在室温下脱色摇床上洗两次,每次 10min;再用 TBS 洗一次,10min。
(3) 同上方法准备二抗稀释液并与膜接触,室温下孵育 1~2h 后,用 TBST 在室温下脱色摇床上洗两次,每次 10min;再用 TBS 洗一次,10min,进行化学发光反应。
(六) 化学发光,显影,定影
(1) 将 A 和 B 两种试剂在保鲜膜上等体积混合;1min 后,将膜蛋白面朝下与此混合液充分接触;1min 后,将膜移至另一保鲜膜上,去尽残液,包好,放入 X-光片夹中。
℃),温度过低时(低于 16℃)需适当延长显影时间;显影结束后,马上把 X-光片浸入定影液中,定影时间一般为 5~10min,以胶片透明为止;用自来水冲去残留的定影液后,室温下晾干。
应注意的是:显影和定影需移动胶片时,尽量拿胶片一角,手指甲不要划伤胶片,否则会对结果产生影响。
(七) 凝胶图象分析
Western blot analysis-1 Cells were cultured in 199 medium with 10% fetal bovine serum. Afterdigestion with 0.25%trypsin and 0.2%EDTA, the cells were collected and were washed threetimes with ice-cold PBS, then were lysed in buffer(50mM Tris-HCl, pH8.0,150mM NaCl, 100μg/ml PMSF, 1%TritonX-100) for 30 min at ice. After removal of cell debris bycentrifugation(12,000g,5 min), the protein concentration of lysates was meatured by Bradfordmethod.50μg proteins of different groups boiled for 5 min in sample buffer and were separated in 10% SDS-PAGE and transferred onto nitrocellulose membrane (Bio-Rad). Nonspecific reactivity was blocked by incubation overnight at 4℃ in buffer(10mM Tris-HCl, pH7.5,150mM NaCl, 2%Tween-20, 4% bovine sreum albumin).The membrane was then incubated with primary antibody. The secondary antibody was used to detected bound primary antibody. Reactive protein was detected by ECL chemiluminescence system (Amersham pharmacia biotech). Western blot analysis-2 The protein expression ezrin was detected by Western blot method.Confluent 150 cm2 flasks of cells were washed three times with ice-cold PBS, then lysed in buffer(50mM Tris-HCl, pH8.0,150mM NaCl, 100μg/ml PMSF, 1%TritonX-100) for 30 min at ice. After removal of cell debris by centrifugation(12,000g,5 min), 50μg of each lysate sample was boiled for 5 min in sample buffer and were separated by 10% SDS-PAGE and transferred onto nitrocellulose membrane (Pall Corporation). Nonspecific reactivity was blocked in 5% nonfat dry milk in TBST(10mM Tris-HCl, pH7.5,150mM NaCl, 0.05%Tween-20) for 1h at room temperature. The membrane was then incubated with monoclonal antibody of mouse anti human ezrin p81(Maixin-Bio) followed by reaction with anti-mouse IgG-HRP antibody. Reactive protein was detected by ECL chemiluminescence system (Santa Cruz). ezrin 蛋白表达通过 Western blot 进行检测。已达融合生长的单层细胞用冷 PBS 洗三次后,加入裂解液(50mM Tris-HCl, pH8.0,150mM NaCl, 100μg/ml PMSF, 1%TritonX-100)冰上裂解 30min,12,000g,5 min 离心去除细胞碎片后,取 50μg 样品与上样缓冲液混合,煮沸 5min,进行 10% SDS-PAGE 电泳,转硝酸纤维素膜(Pall Corporation)。将膜在含 5%脱脂奶粉的 TBST(10mM Tris-HCl, pH7.5,150mM NaCl, 0.05%Tween-20)中室温下封闭 1h,随后加入鼠抗人 ezrin 一抗(Maixin-Bio),抗鼠 IgG-HRP 二抗,ECL 化学发光试剂检测(Santa Cruz)
此文转载:丁香通

