在制备任何抗体前,重要的是首先要确定手头的工作需用多价抗血清(或多克隆抗血清)还是用单克隆抗体才能更好地完成。多价抗血清是多种抗体的混合物,每种抗体都能以不同的亲和力结合抗原上的一个独特表位,而且各种抗体的类或亚类可以是不同的。多价抗血清能够和多种抗原表位结合导致亲和力的增加,但是多克隆抗血清里也含有无关抗体。
实验步骤
材料
1. 免疫原
一旦作出制备单克隆抗体的决定后,首先要考虑的问题是使用何种免疫原(第2章)。免疫原(或抗原)可以有多种:全细胞、细胞提取物、纯化蛋白、融合蛋白、多肽、糖 类 、脂类或 D N A 等 。此外,制备单克隆抗体时不需要很纯或单一特异性的抗原,因为在单克隆抗体筛选的过程时,每个克隆的特异性都会得到体现。全细胞或细胞裂解物(每 次 注 射 I07个细胞)可以作为细胞内或细胞外抗原分子的天然形式; 但特定抗原含量的多少会影响免疫的效果。过度表达特定蛋白质的细胞系通常是很好的抗原来源。纯化的重组蛋白或融合蛋白也是常用的免疫原(每次注射10〜IOOug), 可以产生针对很多不同抗原表位的抗体 。如果免疫原是以融合蛋白存在,重要的是还要制备免疫原本身或免疫原与其他蛋白质的融合蛋白,以便在筛选特异性抗体时,得到针对免疫原的单克隆抗体而不是针对融合蛋白另一部分的单克隆抗体。类似的,多肽抗原(大于1 0 个氨基酸)必须与载体蛋白偶联才能用于免疫。由于这些载体蛋白具有很高的免疫原性,所以多肽应该与不止一种载体蛋白偶联,以便筛选出的单克隆抗体只识别多肽而不识别载体蛋白,如钥孔戚血蓝素(KLH) 和牛血清白蛋白。抗多肽的抗体能鉴别小的线性序列,并且已经被证明能有效地区别靶标是否被修饰,如区分特定肽上的磷酸化或去磷酸化。
近年来,用质粒为基础的技术在体内诱导表达有免疫原性蛋白的新方法已经产生。基因免疫接种在采用下列免疫途径时是相当有效的:脾内注射、肌肉注射[2]、皮内注射(用基因枪[3, 4]等仪器设备进行操作)或静脉注射[5〜 7]等 。这些方法的不同在于将质粒DNA导入宿主细胞的机制不同。然而,每种方法都依赖于哺乳动物表达载体上的独特编码序列 ,这些外源D N A 序列随后被宿主细胞摄取,在体内产生蛋白质。更有用的是,当抗原难以制备或基因产物不清楚时,基因免疫接种可以被运用。质粒为基础的免疫可在体内产生足量的目标蛋白,从而诱导机体产生强有力的体液免疫应答。这种技术还可用在转基因小鼠,产生针对靶抗原的特异性抗体[5』 5a]。
糖类决定基往往表达在病原微生物表面,可以引起适度的体液免疫,但很少引起再次免疫应答。因此,糖类决定基通常只能诱导产生1 g M 的抗体应答,如针对血型抗原的应答 。将糖类抗原偶联在载体蛋白质上后也能增强机体对它的应答。游离的脂质或者脂蛋白 经 C D l分子的抗原提呈后可以诱导产生与这些半抗原样片段反应的抗体。核酸很难诱导体液免疫的产生。
总的来说,抗体分子识别的蛋白质抗原决定基分为三种类型:构象表位、线性表位以及新表位。构象表位是由序列上不相连续的多肽(非线性序列)形成的具有三维结构的表位 。构象表位表示抗原是以天然形式存在的,当蛋白质分子变性时,构象表位会被破坏。线性表位(由相邻氨基酸残基组成的序列)不会因蛋白质变性而破坏,但是当蛋白质处于天然折叠状态时,线性表位可能暴露也可能隐藏在分子内部。抗体结合的线性多肽就是
线性表位的一个例子。新表位是指天然蛋白质水解后新表达的表位。识别新表位的抗体通常不能识别天然蛋白质。
显然,免疫原的形式会影响宿主体液免疫产生的抗体谱。用全细胞、细胞裂解物或者用在体内产生的蛋白质免疫接种会导致产生大量的抗体,这些抗体可用来鉴别表达在天然蛋白质上的抗原表位(构象表位、线性表位和新表位)。这些抗体可能用于广泛生物学功能的研究,包括流式细胞术或功能性中和作用。多肽免疫接种通常只是单一抗原表位的暴露。识别这些线性表位的抗体并不总能结合天然球状蛋白;然而,这些线性表位即便在天然蛋白质变性的情况下通常也是能保存的。这种抗多肽的抗体通常在免疫印迹(Western blot)或免疫组化中工作得很好。因此,选择免疫原制备抗体时应该考虑到所
制备抗体的最终用途, 并应该根据其用途决定用何种方法筛选抗体更合适。虽然不能保证某一种形式的免疫原将会产生有特定功能活性的抗体,但是具有帮助我们筛选到具备独特特异性的抗体的可能性。所需用于免疫接种和抗体初步筛选的蛋白质抗原量大约是 2 mg。
在免疫接种前,检查抗原中是否含有潜在病原体是必要的。这适用于用细胞系、细胞系产生的蛋白质,或者在有血清存在的情况下制备的蛋白质。筛选试验,称为小鼠抗体生产筛查试验(mouse antibody production screening ,MAPS) ,包括用每种特定抗原(2 XIO7 个细胞或10〜IOOug蛋白质)接种经检疫的无特定病原体(SPF)动 物 ,观 察 4 周 。 4周 后 ,收集免疫后动物的血清,和免疫前的血清比较对一系列已知病原体的反应。阳性结果意味着抗原已被污染,应当抛弃;阴性结果表明抗原是安全的,可用于体内注射。
2 免疫用的动物
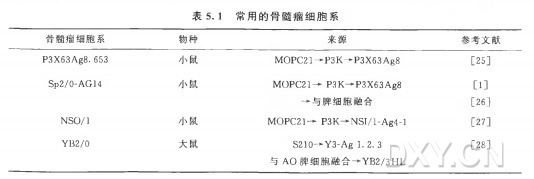
小鼠、大鼠、亚美尼亚仓鼠和兔中分离的淋巴细胞的杂交瘤技术已经很成熟。小鼠是极好的免疫接种对象,原因是:多个纯系株易得到且价钱合理; 小鼠易操作; 有很多试剂可用以检测鼠源免疫球蛋白;小鼠对外来蛋白质能产生良好的免疫应答。另外,小鼠淋巴细胞能够和多种鼠源骨髓瘤细胞系发生有效融合(表 5. 1)。此 外 ,在免疫系统功能得以保留的情况下,基因打靶(gene-targeted)小鼠能够产生针对特定靶蛋白的抗体。大鼠同样是一个好的宿主,尤其是在制备针对小鼠蛋白的抗体时。小鼠和大鼠的骨髓瘤细胞都可以与大鼠的 B 细胞融合。亚美尼亚仓鼠是独特的模型,因为从系统发生学上它们的亲缘关系和小鼠相差甚远,所以能够对小鼠、大鼠或人类来源的蛋白质产生良好的免疫应答,而且能够和小鼠骨髓瘤细胞系发生有效的融合[8』 9,9a ]。更重要的是,亚美尼亚仓鼠产生的抗体在小鼠体内是无免疫原性的,使它们成为一些疾病的理想的体内模型[9——u , lla]。这种模型已经广泛用于制备高亲和力的针对小鼠细胞因子、受体和转录因子等的抗体。
兔的杂交瘤细胞是由免疫兔的脾细胞和兔的骨髓瘤细胞系融合得到的[17]。因此,根据免疫原的来源和抗体的最终用途,一系列的动物模型可供选择用于制备具有所需特异性和功能的独特的单克隆抗体试剂。
一种替代细胞融合制备单克隆抗体的方法是使用淋巴细胞条件转化鼠Cimmortom 〇use)[18]。这些转基因小鼠携带SV4 0 T 抗原的温度敏感突变体,该 基 因 由 H-2Kb 启动子控制。免疫上述转基因动物后,脾细胞在允许的33°C 的培养条件下能够表达热不稳定的 SV40 T 抗 原 ,导 致 B 细胞的转化,从而不需要与永生细胞系融合,而且还避免了由于异核体细胞(杂交瘤细胞)的产生而出现的不稳定现象。从 这 些 不 断 生 长 的 B 细胞中能筛选到分泌特异性抗体的细胞株。
在完善的杂交瘤技术的基础上努力开发更加有效的完全人源化抗体,促使了 Abgenix公 司 XenoMouse的发展[19』 2°]。这 些 转 基 因 小 鼠 完 全 缺 乏 小 鼠 和 「 基因,致使它们缺之所有类型的小鼠免疫球蛋白。这 些 缺 乏 和 Ck 基因的小鼠(Ig基因一/一小鼠)也可通过转基因的方式导入人类IgH及 IgK链基因。因此,转 基 因小鼠XenoMouse具有类似于成年人那样的能够产生多样性初始免疫应答能力的遗传成分,在接受抗原刺激后能够产生强有力的再次应答。常规免疫这些转基因小鼠,将免疫小鼠脾细胞与小鼠源骨髓瘤细胞融合, 是制备一系列高亲和力的能够和任何数量蛋白质反应的完全人源化抗体的新策略。这些抗体具有中和活性,很多已被批准用于人类疾病的治疗。
3 免疫策略
不同实验室使用的免疫策略是不同的,很多免疫策略都同样有效。 目的是扩大宿主体内抗原反应性 B 细胞的数量。体内每次接触到蛋白质抗原,都会增加抗原反应性B 细胞的数量。在对抗原的再次应答中,产生的抗体量会增加,总的免疫球蛋白类别会从以IgM 为主转变为以IgG 为主,特异性抗体的亲和力增高。总体来说,体内的免疫应答越强 ,靶抗原反应性B 细胞数量越多,那么分离到能够分泌所需结合能力和功能活性的抗体的杂交瘤细胞的概率就越大。体外方法进行免疫激活和B 细胞扩增还没有显示高度的可靠性。诚 然 ,对从免疫动物中分离的脾细胞在体外进行激活得到过很好的结果,这种方法制成的杂交瘤主要分泌IgM 单克隆抗体。
特定抗原的免疫原性受多种因素影响,但使用佐剂(第 3 章)可增强免疫原性。佐剂(来源于拉丁语adjuvare,是「帮助」的意思)作为抗原承载物可以阻止抗原的清除,延长抗原在体内刺激免疫系统的时间,募集细胞到抗原所在的部位,并因其能增强共刺激信号和激活免疫系统而刺激淋巴细胞增殖。前面已经介绍了几种佐剂系统,包括弗氏佐剂,是主要的免疫佐剂,用了几十年。然而,弗氏完全佐剂也可以引起不需要的副作用。因此,作为替代品,合成的油包水型乳化佐剂已被开发出来,可降低毒性(如 R ib i或 TiterMax)。此外,明矶可以和抗原一起形成共沉淀,具有低毒性,已经用于某些疫苗中。在某些情况下 ,使用弗氏佐剂不能产生针对特定表位的有效体液免疫应答,但是使用明矾却可以。最后 ,来源于细菌的基因序列—免 疫 刺 激 性 C pG 寡核苷酸序列(含未甲基化的胞嘧啶和鸟嘌呤二核苷酸)最近被用来增强固有免疫, 诱导树突状细胞、单核细胞和巨噬细胞成熟,引 起 T h l细胞介导的细胞免疫,刺 激 B 细胞增殖和免疫球蛋白合成,导致体内保护性免疫的产生[21』 22]。
典型的免疫策略依赖于抗原的反复刺激,以增强特异性免疫应答并使其成熟。表5.2 列出了 — 典型的免疫接种时间表。在这个例子中,抗 原(10〜IOOjMg蛋 白 质 或 IO7个细胞)用弗氏完全佐剂乳化。等量的抗原和弗氏完全佐剂一起乳化成稠厚的乳剂,给小鼠、大鼠或仓鼠多点皮下注射(总 量 0 •5〜1.0 ml)。弗氏完全佐剂中经过热处理杀死的分枝杆菌可以引起炎症反应, 并募集淋巴细胞到抗原沉积的部位。 10〜14d 后 ,经过初次免疫应答产生弱抗体反应(以低亲和力的IgM 抗体为主)。

第一次加强免疫(第二次注射抗原)使用的是弗氏不完全佐剂(弗氏不完全佐剂不含热处理杀死的分枝杆菌,而弗氏完全佐剂中含有;弗氏完全佐剂的重复刺激可导致肉芽肿的形成,所以重复使用弗氏完全佐剂是不适当的)。抗原和弗氏不完全佐剂的乳化物也是多点皮下注射。对蛋白质抗原的再次应答,将产生增强的体液免疫,与初次免疫主要产生IgM 类抗体相比,加强免疫产生的抗体中Ig G 类抗体的数量明显增加。虽然第一次加强免疫后也可以检测到有意义的免疫应答,我们仍然建议进行第二次加强免疫,它能刺激免疫应答的成熟,进一步扩增抗原反应性B 细胞的数量,增加血清抗体的效价。第二次加强免疫后的8〜10d,应该收集免疫后动物的血清,与免疫前血清一起比较对抗原的反应性 。类似的免疫接种时间表也可应用于用质粒D N A 进行的基因免疫接种。已经公开发表的免疫接种时间表有很多,它们在佐剂的选择、注射体积、抗原浓度、剂量及接种次数方面均有不同。前面给出的时间表是一个在多种动物模型中均取得了良好免疫效果的免疫接种时间表之一。
免疫后动物血清的反应性应该以多种稀释倍数,运用多种检测系统来确定体液免疫反应的强度和性质。由于血清组分的复杂性,检测时血清样品的稀释度通常应该大于1 : 50, 以减少非特异性结合。此 外 ,检测时应该包括大于1 : 1〇〇〇, 甚至超过1 : 1〇万的血清稀释度,以便更好地了解体内免疫应答的产生情况。血清效价的定义是: 在任何筛选试验中均能和抗原出现明显的、可检测到的反应的血清最大稀释度的倒数。
根据免疫原性质的不同,有多种筛选方法可以选择使用(在随后的部分详细讨论),包括酶联免疫吸附试验(ELISA )、流式细胞术、免疫沉淀或功能性中和试验。血清的抗体效价最好使用能够监测抗体预期功能的试验体系来评估。也就是说,如果制备的单克隆抗体是用来结合重组蛋白的,那 么 E L IS A 可能是最有效的筛选手段。然 而 ,如果制备的单克隆抗体是用来识别天然的细胞表面受体,那么筛选血清的方法就应该用流式细胞术或者用天然形式存在的抗原来筛选。重要的是要认识到,在一种试验体系中有功能的抗体可能会在另外一些实验体系失去结合活性。识别构象表位的抗体,在免疫印迹(Westernblot)中,由于蛋白质是变性的,可能不会出现结合反应;同样,识别隐藏在球形蛋白内部线性表位的抗体,可能不能抑制该蛋白质的功能活性。因此,在设计免疫程序和选择筛选手段时,对抗原的性质有清楚的认识及考虑制备抗体的用途是很重要的。通常, 如果免疫后血清效价> 1 : 1000, 建议继续进行随后的杂交瘤融合。如果血清效价< 1 : 1000, 应该继续加强免疫以增强机体对抗原的应答。
有时,即便经过多次加强免疫,也只能检测到很弱的免疫反应。虽然从那些低血清效价的动物也筛选到抗原特异性的杂交瘤细胞,但得到这种克隆的概率很低,并且通常是分泌 IgM 类抗体的杂交瘤细胞。在这些情况下,重新审查最初的免疫策略是明智的选择,可以改变抗原的形式,或者所用佐剂的种类。使 用 C F A /IF A 作为佐剂不能诱导产生有效免疫应答的抗原,在换用明矾作为佐剂后可能会大大提高免疫原性。
免疫后动物经过检测显示有意义的血清效价(> 1 : 1000) 后 ,动物应该「休息」3〜6周 。这段时间是让增强的二次应答衰减,以便在最后一次接触抗原后导致新的 B 细胞的活化和扩增。「休息」后的动物要接受最后一次融合前的冲击免疫,抗原用无热原的生理盐水或磷酸盐缓冲液稀释 (总量 200uL) ,不含佐剂。冲击免疫的最有效途径是静脉注射,可以将抗原直接输送到脾脏,脾脏中新活化的 B 母细胞收获后可用于做融合。如果抗原
不适合静脉注射 (如抗原是颗粒状的,或者含有的缓冲液成分可能有毒),可以采用不含佐剂的抗原腹腔内注射进行冲击免疫。不适合做静脉注射的成分包括弗氏佐剂、浓度大于0.1 % 的清洁剂/去垢剂,大 于 lmol/L 的尿素、内毒素、T ris 缓冲液、NaN3,或者超过生理浓度的缓冲液和盐水。经静脉注射冲击免疫后 3d(经腹腔内注射冲击免疫后 4d) ,收获免疫脾细胞或淋巴结细胞用于融合。
3 免疫程序
3.1 培 养 基 和 骨髓 瘤细 胞
制备分泌抗体的 B 细胞杂交瘤细胞依赖于抗原反应性B 细胞与永生化的B 细胞肿瘤细胞(骨髓瘤细胞)的高效率融合、随后的鉴定以及对能持续生长的能产生特异性抗体的细胞系的分离。对筛选了的杂交瘤细胞系的扩增培养需要很熟练的组织培养技术和对这些脆弱细胞的非常认真的照顾 [23]。虽然有多种不同的培养基和培养条件都可用于杂交瘤细胞的培养,但是在这里介绍一种可靠的方法,能够得到显著的结果(表 5. 3)。最好选择营养丰富的培养基培养细胞,因为细胞融合过程,以及随后的细胞扩增和低密度的亚克 隆 ,对杂交瘤细胞都是很大的压力。符 合 这 些 条 件 的 一 种 培 养 基 是 高 糖(4. 5 g/L )DMEM(也 可 使 用 RPMI-1640 或 IMEM)。 D M E M 中 加 入 10% 〜 20% 的胎牛血清(FBS)、4 mmol/L 的 L-谷氨酰胺、l mm〇 l/L 的丙酮酸钠、50U/m l 的青霉素、50ug/m l 的链 霉 素 和 SOu mol/L 的 2-巯基乙醇 (2-ME) ,就成了 DM EM 完全培养基。

由于细胞培养时间长,所有的培养基组分都应该用 0. 22p m 的过滤器过滤除菌,而且在 4°C 储存的时间不能超过 2 周 。 F B S 优于其他来源的血清,因为它含牛的免疫球蛋白量 低 ,牛的免疫球蛋白可能会干扰后续抗体的筛选或纯化。在用于杂交瘤细胞培养前,也应该对不同批次的 FBS(或血清替代品)进行筛查,因为不同批次的 F B S 促进杂交瘤细胞的 生 长 能 力 不 同 。所 有 的 试 剂 都 必 须 是 无 支 原 体 污 染 的 ,而 且 内 毒 素 含 量 低(<0.25EU/ml)。在 DM EM 培养基中添加L-谷氨酰胺和丙酮酸钠,可以支持细胞的旺盛生长 。抗生素是可选的;然而,由于杂交瘤细胞的培养需要好几周时间的反复操作,因此,在培养基中添加对革兰氏阳性细菌和革兰氏阴性细菌都起作用的抗生素是明智的。在支原体 染 的 情 况 下 ,用环丙沙星(ciprofloxation)(lO^g/ml)替代培养基中的青霉素和链霉素 ,至少培养5 代 。在培养基中加人2-M E 是有争议的,因为其作用机理不明。虽然在没有 2-M E 的情况下也能制备出杂交瘤,但是添加后对很多培养会有益处 。 一 旦在杂交瘤细胞的培养基中添加了 2-M E 后 ,就不能够再将其从培养液中去除了,因为这样做,可能会导致免疫球蛋白分泌或杂交瘤细胞生存能力的显著下降。
最近对杂交瘤细胞培养过程的改进包括研制出无血清或完全不含动物蛋白的培养基 。这对下游的杂交瘤细胞大规模扩增和单克隆抗体的生产提供了很好的选择。很多这样的新型培养基已被用于杂交瘤细胞的高密度培养和简化单抗的纯化程序。但这些新型培养基在杂交瘤细胞的起始培养中的效果还有待证明。在很多情况下,随着培养基中血清浓度的减少,抗体的产量会增加。
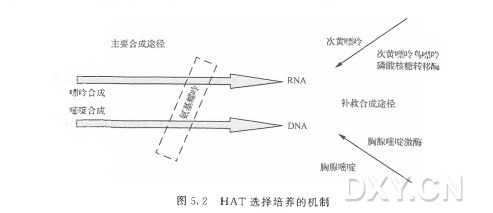
细胞融合后,培养的细胞要用药物进行选择,以清除那些未能融合形成杂交瘤细胞的骨髓瘤细胞。有很多筛选试剂可供选用,主要根据特定骨髓瘤细胞系特异的突变而定。HAT是最常用的筛选药物,表 5. 1 中 所 列 的 骨 髓 瘤 细 胞 系 都 可 用 此 药 物 进 行 筛 选 。HA T 可 通 过 多 种 商 业 途 径 买 到 ,由 次 黄 嘌 呤(hypoxanthine, 100pm〇l/L) 、 氨基蝶呤(aminopterin, 0. 4jumol/L)和胸腺啼陡(thymidine,16jamol/L )组成。氣基蝶呤可以阻断所有细胞内的嘌呤和嘧啶的从头合成途径。次黄嘌呤和胸苷可参与细胞内嘌呤和嘧啶的补救合成途径(图 5.2 )。在杂交瘤细胞初始的生长及扩增过程中,可能需要添加一些额外的生长因子或补充物。虽然有些实验室会使用由滋养细胞层(脾细胞或腹腔巨噬细胞)产生的条件培养基「 conditioned media」, 但 是 也 可使用提供IL-6 来源的商品化的添加物(Origen HCF, IGENInc., Gaithersburg, MD)。如果要使用滋养细胞层,应该在使用前1〜2d 将其接种在96孔细胞培养板中,每 孔 75/zl,含 4 X IO3 个腹腔灌洗细胞或IXl O4 个脾细胞 。这样确保滋养细胞产生了细胞因子,有利于杂交瘤细胞的生长,同时也能让研究者确认滋养细胞层是无污染的, 污染的滋养细胞会危及杂交瘤细胞的生长。另外,商品化的添加物应按商家推荐的浓度使用,一 般 是 1 % 〜5%(体积比),可以在使用时直接添加到培养基中。养细胞和商品化的添加物在促进新形成的杂交瘤细胞生长的效果方面基本相同。
骨髓瘤细胞应该装入冻存管后储存在液氮中,每次细胞融合解冻复苏一管新细胞。确保冻存的骨髓瘤细胞没有受到支原体污染非常重要,并且应该检查不存在任何传染性微生物,检查方法和前面提到的筛选免疫原时用的方法一样(小鼠抗体生产筛选试验,MAPS)。骨髓瘤细胞在融合前的培养时间不应超过两周,要始终保持细胞处于对数生长期 ,密度不超过IO6 个细胞/ml。骨髓瘤细胞通常用含i 〇 %FBS的 DMEM完全培养基培养(如前所述),每周传代 3 次 ,密 度 为 2. 5 X IO4〜10. OXlO4 个细胞/ml , 取决于不同骨髓瘤细胞的生长速度。常规地,应该取一些骨髓瘤细胞培养在含H A T 的选择培养基中,以确定是否所有的细胞都会死亡、是否这些骨髓瘤细胞被污染、选择试剂是否有效等。在与抗原反应性B 细胞融合前,骨髓瘤细胞要用无血清培养基在4°C 条 件 下 洗 3 次 ,因为血清中蛋白质会干扰膜融合。用无血清的DMEM重悬骨髓瘤细胞,对其进行计数,调整浓度为I XlO7个细胞/ml, 放 在 4°C 。骨髓瘤细胞的活细胞比例应大于9 5 % 。
3.2 免 疫 B 细胞的制备
血清效价有意义(>1 : 1000)的免疫后动物可以提供抗原反应性B 细胞用于融合。这些细胞可以从脾脏或淋巴结中获得。动物用吸人CO2 处死,在无菌操作下取组织,放 在 4°C无血清培养基中,最多可放lh 。用慑子或针头轻轻打开组织脾脏或淋巴结的外包膜获得单细胞悬液,不能用毛玻璃磨碎组织取细胞,因为那样可损害细胞膜的完整性。在准备骨髓瘤细胞的同时,脾细胞或淋巴结细胞用无血清培养基洗3 次(4°C ,1000r/m in离 心 lOmin) ,计数并用 20m l 无血清培养基重悬,放 入 50m l 聚丙烯离心管,置于冰上。通 常 ,1 只免疫后小鼠可收获得IXlO8 个脾细胞,免疫后亚美尼亚仓鼠可收获得0.6X 108 个脾细胞。
3.3 融合和铺板
细胞融合前, 所有材料和设备都应准备好,培养基组分要预热到合适的温度(图 5. 3)。
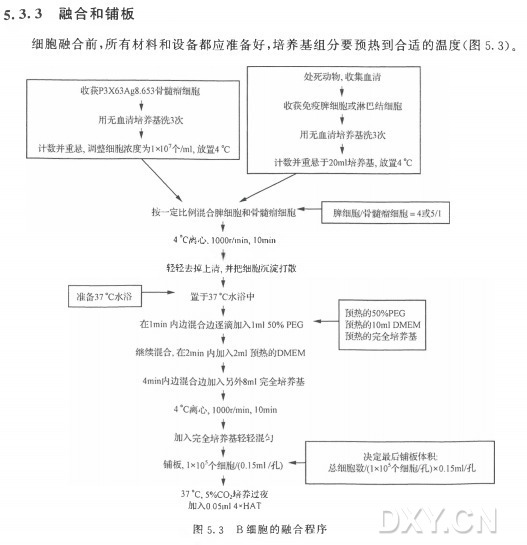
生物安全柜要彻底清洁,并 用 7 0 % 乙醇擦拭。所有培养基组分要滤过除菌。电子移液器应该安装有新的滤膜,多道移液器应该擦拭以减少任何污染机会。如果使用滋养细胞,含滋养细胞层的细胞培养板应该放在显微镜下检查细胞有没有污染。其他需要用到的物品包括计时器和2m l 、10m l 和 25m l 的移液管。免疫反应性B 细胞和骨髓瘤细胞重悬于无血清培养基中,并保存在4°C 条件下。下列组分要预热至37°C : 隔热的烧杯(充当水浴),5 0 % 聚乙二醇溶液(每个脾用lm l) ,IOml含 1 0 % F B S 的 DM EM 完全培养基,最后铺板用 的 含 2 0 % F B S 的 DMEM完全培养基。细胞计数,并计算活细胞比例,做记录。根据计数结果确疋骨髓瘤细胞的用重(见下述)和最后铺板所需的培养基用量(I X IO5 个细胞/孔)。
在细胞融合前将免疫淋巴细胞与骨髓瘤细胞按一定的比例混合。两 者 的比例由于使用动物的不同、骨髓瘤细胞系的不同,以及不同的实验室之间都会有少许的差异。在我们实验室,小鼠或大鼠的脾细胞与骨髓瘤细胞(P3X63Ag8. 653)混 合 的 比 例 是 5: 1。亚美尼亚仓鼠脾细胞与骨髓瘤细胞混合的比例是4 : 1。为了更好地产生B 细胞杂交瘤,骨髓瘤细胞是按照适当的比例加人到免疫脾细胞或淋巴结细胞中的。例 如 ,2 X 107 个骨髓瘤细胞应该和I X l O 8 个小鼠脾细胞混合。混合细胞在50m l尖底离心管中混合后,在 4°C ,1000 r/min,离 心 lOmin。离心后,将上清液完全倒干净,将管底的细胞沉淀震动打散,使细胞均匀地铺在管底。将含有骨髓瘤细胞和B 细胞混合物的试管放在含有37°C 热水的隔热烧杯中。
以下的操作都在37°C 进行。在 37°C 的时候,细胞膜的流动性更大,这 对 由 p e g 1500介导的细胞融合过程是有利的。保温的细胞混合物、37°C 预 热 的 5 0 % PEG 、预热的含1 0 % F B S 的 D M EM 都放在超净台中。为了使免疫反应性B 细胞与骨髓瘤细胞融合,在37°C 水浴中,一边旋转轻轻摇动细胞管 ,一 边将混合细胞中逐滴加人lm l的 50% 的 PEG
溶液(lm in 内加完)。盛有混合细胞的锥形离心管与水平面应成一个角度,以便使每一滴P E G 都能轻轻地沿着细胞悬液的上缘与铺在管底的单个细胞均勻地混合。将融合细胞在 37°C 再 轻 轻 旋 转 30s 。随后,P E G 下 面 在 一 系 列 定 时 加 人 的 预 热 的 含 i 〇 %F B S 的D M EM 中慢慢稀释。首先, 在37°C 的水浴中于2m in内边旋转边加入2m l预热的含10%F B S 的 DMEM,然后,同样在2m in内边混合边加人8m l的上述培养基。这种稀释的包含脾细胞、骨髓瘤细胞及新形成的杂交瘤的混合物在4°C 1000r/min离 心 lOmin。然后弃上清,细胞沉淀用含2 0 % F B S 的 D M EM 完全培养基轻轻重悬,使用大口径的移液管(25 ml)重悬。新形成的杂交瘤细胞很脆弱,不要用力振荡或涡旋。
将新生成的杂交瘤细胞重悬在适当体积的培养基中,使每孔约含细胞I X l O 5 个 ,接种在带低蒸发盖的9 6 孔板中。如果杂交瘤细胞要接种在已含有滋养细胞层(每 孔 75ul的腹腔灌洗细胞或脾细胞)的板中,那么新的融合细胞重悬后的浓度应为L 3 X 106 个细胞/ml , 每 孔 加 75^1, 这样铺板后的融合细胞密度为I X l O 5 个细胞/孔 。每孔细胞总体积为 150/^1。 如果不使用滋养细胞,那 么 要 在 含 2 0 % FBS的 DMEM完全培养基中添加生长因子,如 添 加 1 % 〜5 % 的杂交瘤细胞克隆因子(Origen HCF, IGEN Inc.)。在这种情况 下 ,新生成的杂交瘤细胞重悬后的浓度应为6. 7 X IO5 个细胞/ml, 以 便 使铺板后每孔150/^1中含有I X l O 5 个细胞,跟前面描述的一样。每 孔 15〇沁含 I X l O 5 个融合细胞的细胞培养板在 37°C ,5 % CO2 和 9 5 % 湿度的条件下培养过夜。融合后第一天,细胞要在含H A T 的培养基里选择培养(每 孔 加 50jul的 含 2 0 % F B S 的 D M EM 完全培养基十4 倍浓度 的 HAT)。此时,每个孔里都有很多活细胞,没有或很少有细胞碎片。在融 合 后 的 24 h而不是融合的同时加入11八丁(50; /1,4 \ ^ :八丁浓缩液),目的是使细胞从融合过程的最初压力中恢复过来,从而提高阳性克隆的产量。
细胞在选择培养基中培养(嘌呤和嘧啶生物合成的主要途径被氨基蝶呤阻断),骨髓瘤细胞(缺 乏 HGPRT)如果没有或没有有效地与脾细胞融合,将由于缺乏核酸补救合成途径所需的酶而开始死亡。同样,没有与骨髓瘤细胞融合的脾细胞在培养基中也只能活几天。培 养 3〜5d 后 ,能明显地观察到活细胞数量的减少和细胞碎片的增强。融合后第5 天开始,细胞培养板一周要换液三次。用吸管或多道移液器吸去一半的细胞培养上清(约lOOul)。无菌的移液器吸头插人培养孔的一半,将上清轻轻吸出,不要搅动底部的细胞 。然后补人1〇〇 〜125JU 丨含I X H A T 的新鲜DM EM 完全培养液(含 2 0 % FBS) ,如果最初没有使用滋养细胞的话,培养基中还应添加生长因子。常规地换液是给生长中的杂交瘤细胞补充营养物质,维持细胞健康、旺盛生长,去除细胞代谢产生的废物和死亡细胞碎片 ,减少培养孔中由未融合的B 细胞或不能増殖的不稳定杂交瘤细胞分泌的免疫球蛋白。通过给细胞频繁更换培养液,可以去除暂时表达的抗体,以减少筛选过程中假阳性孔出现的可能性。这在免疫后动物血清效价高(> 1 : 50 000)的融合中是很明显的。融合细胞要在含H A T 的选择培养基中培养大约2 周 。以后的培养可由H T 替 代 H A T ,因为未融合的骨髓瘤细胞已不复存在了,不再需要氨基蝶呤的选择作用了。
融合 后 约 14d,大多数细胞培养孔都显示细胞生长旺盛。检查细胞培养孔,可见葡萄串样的杂交瘤细胞团变得更加明显,并不断增大。根据接种时描述的条件(I X l O 5 个细胞/孔),每个细胞培养孔中都有可能长出多集落的杂交瘤细胞。每孔不一定是单克隆。一般来说,按照上面建议的细胞接种密度,8 0 % 以上的细胞培养孔中都应有活性分裂细胞 。如果含有活性分裂细胞的孔比例低,原因可能是融合时骨髓瘤细胞健康状态不好(如
细胞不处于对数生长期)、经静脉冲击免疫后B 细胞没有被有效地激活、细胞没有被有效融合、细胞培养条件不适当或支原体污染等。在大多数有杂交瘤细胞生长的培养孔中,当细胞生长达到铺满5 0 % 孔底时,此时细胞培养上清中的抗体(可 达 到 l ^g/ml)足以用来鉴定抗原。取一半的细胞培养上清用于抗体筛选试验。用于筛选试验的细胞培养上清应该是培养了 2d 的细胞培养上清,以使培养液中的抗体达到最高水平。每个细胞培养孔都必须使用一个单独的移液器吸头,以防止交叉污染。当细胞培养上清被转移到复制板中后 ,要给杂交瘤细胞补充新鲜的培养液(如上所述)。由于这些杂交瘤细胞是处于对数生长期,所 以在48 h 内确定筛选结果是必要的,以便对阳性克隆进行扩增或其他处理。杂交瘤细胞仍然用含H T 和 2 0 % F B S 的 DM EM 完全培养基培养。
3.4 筛选
有很多筛选策略可用于杂交瘤细胞的筛选。常见的方法包括酶联免疫吸附试验(ELISA)、免疫沉淀、结合抑制试验、流式细胞术、免疫印迹分析、免疫组化和功能中和试验等。在选择筛选方法时的一个重要思考是「你的抗体用于什么就用什么去筛」。筛选策略必须能够反映所需抗体随后的用途。例如,ELISA作为筛选手段筛出的抗体可能不能结合表达在细胞表面上的天然分子,这些分子要用流式细胞术检测。同样, 用功能中和试验筛选出的杂交瘤细胞分泌的抗体可能不能用于免疫印迹分析或免疫组化。
在选择筛选策略时,必须要考虑下面的因素:能够处理多达1000个样品(约 12 0 ul/样品)的能力、48 h 内完成鉴定的能力、是否具备必要的试剂/设 备 、反应的特异性、实验体系的灵敏性,以及最重要的是否能得到结果。筛选时要用融合前的免疫血清作为阳性对照。这将确保所有的技术、试剂、设备是最合适的。同样,用培养杂交瘤细胞的培养基(作为阴性对照)评估筛选结果也是很重要的。这种 含20%FBS及生长因子的培养基可能会干扰一些实验检测。例如,HAT/HT选择培养基中含有高浓度的胸腺嘧啶,在增殖实验中可以阻止3 H-胸腺嘧啶的有效结合。为了鉴定出分泌所需单抗的杂交瘤克隆,通常需要用多个、多层次的筛选手段。用培养了 48 h 的杂交瘤细胞培养上清可用于多个筛选实验,多种筛选实验数据的汇总用来确定产生抗体的杂交瘤细胞。
免疫原的性质对筛选方法的选择也是有帮助的。用肽抗原制备的抗体筛查可将肽抗原结合在酶标板上,很容易地用ELISA进行筛选,然后进一步用其他的筛选方法以鉴定抗体的其他功能。流式细胞术可用来检测和表面球蛋白反应的抗体,然后再进一步用功能中和实验或配体结合抑制实验来筛选。另一个要考虑的事项是抗体的同种型。能特异性识别免疫球蛋白同种型的二抗可用来检测抗原反应性抗体是IgG 重 链 而 不 是 Ig M 重链 。重要的是,确定阳性克隆(和丢弃阴性克隆)必须依据两个独立的筛选试验的结果,即使是完全相同的实验操作重复一次也是需要的。因为在筛选融合细胞时,重复试验有助于评估实验体系的重复性,减少出现假阳性或假阴性的风险,有助于鉴定出反应最强的细胞 系 ,并为选择杂交瘤细胞系提供多种参数。阳性克隆扩增后供进一步分析,而阴性克隆就舍弃了。重要的是要记住,最初筛选得到的阳性孔细胞并不是单克隆,可能呈现出多种结合特性。
3.5 亚 克 隆 和 低温 冻存
平均来说,用典型的融合方法制备的杂交瘤,1 % 〜3 % 的孔会分泌能够与抗原反应的抗体。一旦使用两个独立的筛选试验确定了阳性克隆,这些细胞应该立即进行亚克隆, 分离出能够分泌抗体的单克隆杂交瘤细胞,同时扩增并冻存该原始阳性克隆。阳性克隆中通常含有不止一种稳定的杂交瘤细胞,因此,必须再进行克隆,以便得到只分泌一种抗体的单个克隆的杂交瘤细胞。在原始孔中可能存在着不分泌抗体的杂交瘤细胞和含不稳定染色体的杂交瘤细胞,这些细胞的生长能力可能比分泌抗体的杂交瘤细胞更强。单细胞克隆化是一个漫长(数星期到数月)而辛苦的过程,但是对分离能够产生高水平预期抗体的稳定杂交瘤细胞是必需的。有几种同等价值的亚克隆方法可供使用,包括有限稀释法和软琼脂克隆法。
在这里,我们介绍有限稀释法,是一种简单、易操作的技术。无论选择哪种方法,杂交瘤细胞都要经历至少两轮亚克隆,以减少两个细胞正好黏在一起形成克隆的可能性。这不仅为分离单克隆杂交瘤细胞提供了机会,也为选择具备最佳生长特性和分泌高水平抗体的杂交瘤细胞提供了机会。培养低密度的杂交瘤细胞需要滋养细胞或条件培养基以提供生长所需的生因子。如上所述,滋养细胞可用同系动物的脾细胞、胸腺细胞或巨噬细胞。原代培养的细胞是生长因子的极好来源,由于其在体外生存能力有限,不会污染长期培养的杂交瘤细胞。从未接触过目的抗原的动物组织中制备单细胞悬液。这些细胞的铺板密度为2 X 104 个细胞/孔(与 细 胞 融 合 时 铺 板 的 滋 养 层 细 胞 密 度 相 比 ,亚 克 隆 过 程 要 用 更 高 的 细 胞 密度),0. Iml/孔(9 6 孔细胞培养板)。同样,滋养细胞层至少应该在使用前1 天 铺 板 ,使产生的生长因子积累在培养上清中,同时也可用来验证原代培养的细胞没有污染。另外 ,许 多商品化的生长因子补充剂(很多都含IL-6)可以取代饲养细胞的使用。克 隆 时 ,按照制造商的产品说明书将这些产品简单地加到培养基中就行了。
按照下面的操作程序可以获得单个克隆的细胞。对杂交瘤细胞进行适当的稀释以使细胞能以三种浓度铺板:100个细胞/孔 、1 0 个细胞/孔 和 1 个细胞/孔 。初始克隆鉴定出的抗体分泌阳性孔,让细胞生长到近8 0 % 的汇合,然后轻轻地重悬,并进行活细胞计数(不能被台酚蓝染色的确定为活细胞)。取 5000个活细胞转入装有5m l含 H T 的 DMEM完全培养基(亚克隆过程中最好不要改变培养基成分)的聚丙烯锥形管中,这样形成的细胞悬液浓度为1000个细胞/ml。利用这种细胞悬液,依次进行1〇倍稀释,便可分别得到浓 度 为 100个细胞/ m l和 1 0 个细胞/m l的细胞悬液。在两块已添加滋养细胞或补充成分 (100^1/孔)的 9 6 孔细胞培养板的最上面一行(A 行 )加 入 100^1浓 度 为 1000个细胞/ml的细胞悬液,使每孔含有100个有活力的杂交瘤细胞。这种密度的细胞,大 约 在 1〇 d 内能生长到汇合。在每块细胞培养板的B 行 ,加 入 100^1浓 度 为 100个细胞/ml 的细胞悬液,使每孔中含有1 0 个有活力的杂交瘤细胞。在细胞培养板的其他几行(C 〜 H 行)加入100ul 浓 度 为 1 0 个 细 胞 /m l的 细 胞 悬 液 ,使 每 孔 中 含 有 i 个 有 活 力 的 杂 交 瘤 细 胞
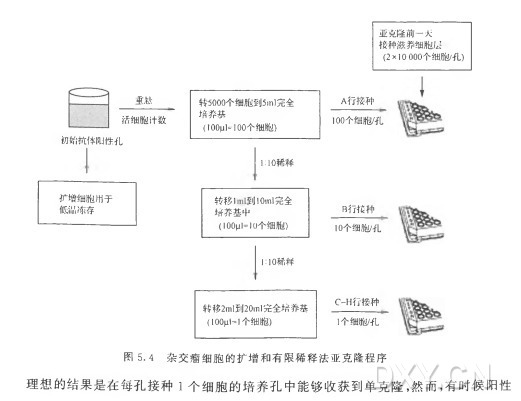
克隆很少或生长很慢,只能从接种较高密度接种的细胞孔中分离阳性克隆,因此,在一些孔中每孔接种1 0 个细胞或100个细胞,当不能从接种单个细胞的孔中得到克隆时,可以从这些孔中得到。这种分离得到的不一定是单克隆,应该进行多轮亚克隆筛选。最好是从 接 种 1 个细胞的培养孔中选择克隆。应该从视觉上检查每个培养孔中单独克隆的形成 。此外统计分析表明,在接 种 1 个 细 胞 的 培 养 孔 中 ,得 到 的 阳 性 孔 里 6 3 % 是单克隆[24]。每个原始阳性克隆都应该用有限稀释法进行至少两轮亚克隆。对每个原始克隆进 行 的 3 次亚克隆都鉴定是审慎的,扩增并冻存这些克隆以进行进一步亚克隆或分析。如果很难获得单克隆的杂交瘤细胞,可以在亚克隆前用流式细胞术对杂交瘤细胞进行分选 。杂交瘤细胞由于表达膜表面免疫球蛋白可以被染色,分 离 1 % 的阳性细胞,然后用有限稀释法铺板。这种方法可能有助于更迅速地分离和鉴定产生最高水平抗体的杂交瘤克
隆 。不能鉴定出任何阳性克隆可能是由于技术上的困难、铺板密度计算错误或者可能反映最初鉴定培养条件的严重不稳定性。在亚克隆的整个过程中都应该进行原始阳性克隆的培养,并监测抗体产生的稳定性。如果这一段时间细胞培养抗体检测始终是阳性的,那么它们可作为再次用有限稀释法进行亚克隆的细胞来源。如果在持续培养的过程中抗体产生变为阴性的话,说明这些细胞系可能是不稳定的。这时需要解冻冻存的原始克隆, 在体外扩增2〜3d,然 后 在 6 块或更多的9 6 孔板中进行亚克隆(如上所述)。这将是重新获得分泌特异性抗体杂交瘤细胞的最好机会。在亚克隆的过程中,通 常 有 高 达 2 0 % 的初始鉴定为阳性的克隆变为阴性,不再分泌抗体;因此,如果可能的话,应该鉴定多个分泌抗体的细胞系并建库冻存。
一旦单克隆的杂交瘤细胞系已确立并建库冻存,就应该换成不含H T 的培养基培养细胞,并逐渐减少任何生长因子的添加。这可能需要多次传代的适应过程,每代减少一半的生长因子。这期间,细胞的增长率可能会降低;然 而 ,这往往伴随着抗体产生的增加。在所有的添加物都已去除后,FBS的使用浓度也可减少。通常情况下,培养杂交瘤细胞的 FBS浓 度 可 以 从 20%、1 5 % 、1 2 % ,并 最 终 过 渡 到 10%。一 些 细 胞 系 ,甚 至 可 用 5%FBS培养,并最终用无血清培养基培养。每一步都应该对杂交瘤细胞的生长特性和抗体产生能力进行监测。单克隆的杂交瘤细胞确立后,其分泌的免疫球蛋白的同种型也能够被确定。有多种商用的试剂盒及试剂可供使用。同种型的鉴定对于选择抗体的纯化方法是至关重要的,也会影响特定抗体的功能。
原始的阳性克隆及头三次亚克隆的细胞株扩增后都应该冻存。单个孔的细胞扩增慢 ,细胞密度维持在I Xl O5〜I X l O 6 个细胞/ml。冻存前,细胞应处于对数生长期。 4℃离心收集细胞,用已滤过除菌并预冷到4°C 的 含 1 0 % DM SO的培养基重悬细胞沉淀,并调整浓度为5 X 106 个细胞/ml。多管 装 有 I m l细胞悬液(5 X 106 个细胞)的冻存管先在一70°C 冻存数天,然后转移到液氮中长期储存。细胞系在鉴定和分离的每一阶段都应冻
存••包括初始融合时鉴定的阳性克隆,第一轮和第二轮亚克隆的阳性克隆。此 外 ,每一步应该冻存多个克隆,在关键的细胞系丢失后能从前面的冻存克隆中找回 。 一 般来说,每次克 隆 冻 存 1 0 管是合适的。液氮中的细胞可保持数十年,虽然隔几年将这些细胞复苏并重新冻存是明智的。
3.6 杂 交瘤 细 胞 的 扩 增
在产生特异性抗体的杂交瘤细胞分离、克隆并冻存建库后,扩增杂交瘤细胞可生产抗体 。处于对数生长期的杂交瘤细胞培养上清可产生3〜20p g /m l的抗体。根据实际所需单克隆抗体量,可选用不同杂交瘤扩增方法(第6 章)。扩增前,杂交瘤细胞必须是单克隆的 ,以防止不分泌抗体的细胞过度生长,降低抗体的产生。在很多情况下,需要的抗体量不 足 20 mg,那么使用细颈瓶或滚瓶简单的扩增细胞就可产生足够数量的抗体供使用。如果需要生产20〜200m g的抗体,可以使用滚瓶培养,或者使用经专门设计的能供细胞局密度生长的细颈瓶培养(CeLLine flask, Integra), 或者小型生物反应器扩增细胞。大规模的抗体生产需要专门设备和专门技术,或者从多轮小规模的抗体生产中累积得到。
杂交瘤细胞可以在多种不同类型的培养基中培养以进行扩增和抗体生产。许多杂交瘤细胞可在低浓度的血清(2 % 〜5 % ) 或专门的无血清培养基中生长。应该尽量使用牛免疫球蛋白含量低的血清培养杂交瘤细胞,以免在最后抗体制备中有其他的污染抗体。有专为杂交瘤细胞准备的无血清或不含任何动物蛋白的培养基可供购买,以利于抗体的生产和纯化。不同的杂交瘤细胞对不同类型的培养基的反应可能不同,因此在进行大规模扩增前,应该对其在不同类型培养基中的生长情况和抗体产生水平进行评估。在大规模扩增时还要考虑的一个因素是所用培养基的质量。所有试剂都应检测内毒素的污染情况 ;最好使用内毒素含量低于0. 2 EU/m l的试剂。内毒素污染可以改变体外培养细胞的反应,也可导致供体内使用的抗体无用。有多种产品可用于去除抗体中的内毒素,然 而 ,它们也常常导致大量蛋白质的丢失。细胞培养上清中的抗体,可直接用于多种实验体系(免疫沉淀、免疫印迹分析),但在许多应用中需要使用纯化的单克隆抗体。抗体纯化的方法 在 第 7 章讲述。抗体的纯化程序依赖于特异性抗体的种属来源和同种型。单克隆抗体化后,最后应该对抗体的特异性和质量进行监测。有一些参数可用于对抗体的评估,包括无菌、浓度(> 0. lmg/ml)、纯度( 用 SDS-PAGE 检测)、相互凝集的情况、内毒素污染(在体内使用时< 〇.2EU/mg)和蛋白质 A 的污染(< 5 0 ng/ml)
4 结论
单克隆抗体是重要的研究工具、诊断试剂和临床治疗手段。方法学在抗原制备、免疫策略、高通量筛选和抗体生产等方面的不断发展加速了新型抗体试剂的产生、鉴定和生产 。如今,单克隆抗体不仅被用于研究和实验室诊断,并且已经被作为治疗试剂在多个领域都有广泛的用途,如移植、肿瘤学、感染性疾病和很多其他学科领域。此 外 ,抗体的修饰 ,包括添加标签、嵌合抗体、人源化抗体和基因工程抗体,都在扩大其在很多领域的用途 。表 5. 4 提供了一个网站列表,提供了一些关于已制备出的抗体和杂交瘤细胞的来源、操作手册、问题的诊断和解决方法指南、供应商和各种抗体相关链接的信息。许多商业机构可以为客户提供杂交瘤制备技术; 然而,对那些基本的组织培养技能的研究者,这里描述的方法为自己成功制备杂交瘤打下了基础。精心设计的免疫方案和筛选策略将会使你分离和鉴定出能分泌所需特异性抗体的独特的杂交瘤细胞。因此,杂交瘤技术的发展和抗体生产将继续履行他们的承诺:单克隆抗体在医学领域及工业上都是有应用价值的工具 [1]。

此文转载:丁香通

